题目内容
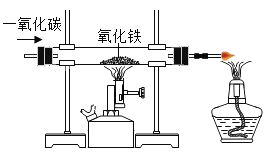
【题目】碳酸亚铁(FeCO3)可用于制作补铁药物,以下是用硫铁矿烧渣(主要成分为Fe2O3SiO2 等)为原料制备碳酸亚铁的生产流程示意图: 已知 40℃以上,(NH4)2CO3易分解。
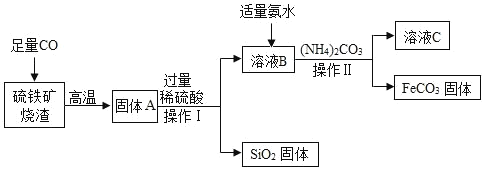
(1)操作Ⅰ的名称为_____该操作所用到的玻璃仪器有烧杯玻璃棒和_____。
(2)写出向硫铁矿中通入 CO 的化学方程式_____。
(3)加入(NH4)2CO3后,该反应必须控制的条件是温度_____。
(4)写出溶液 B 中主要成分的阴离子符号_____。
(5)从溶液C中可回收一种化工产品(NH4)2SO4,请写出它的一种用途用作_____。
【答案】过滤 漏斗 Fe2O3+3CO![]() 2Fe+3CO2 低于40℃ :SO42- 可以用于制作氮肥
2Fe+3CO2 低于40℃ :SO42- 可以用于制作氮肥
【解析】
(1)操作Ⅰ将固体和液体分离的名称为过滤;过滤操作所用到的玻璃仪器有烧杯玻璃棒和漏斗(带滤纸)。
(2)向硫铁矿中氧化铁与一氧化碳反应产生铁和二氧化碳的化学方程式:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)加入(NH4)2CO3后,该反应必须控制的条件是:温度低于40℃,因为40℃以上,(NH4)2CO3易分解;就不能与硫酸亚铁反应产生碳酸亚太和硫酸铵;
(4)铁和过量稀硫酸反应产生硫酸亚铁溶液 ,B溶液中主要含有硫酸亚铁和过量的稀硫酸,其成分的阴离子是硫酸根离子,符号:SO42-;
(5)从溶液C中可回收一种化工产品(NH4)2SO4,硫酸铵中含有氮元素,可以用于制作氮肥;

 阅读快车系列答案
阅读快车系列答案【题目】某化工厂生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥93%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把120g稀盐酸平均分成四份依次加入样品中,每次均充分反应。实验数据记录如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀盐酸的质量/g | 30 | 30 | 30 | 30 |
烧杯及所盛物质总质量/g | 186.2 | 214.4 | 243.6 | 273.6 |
请你据此分析计算:
(1)第_____次加入的稀盐酸完全反应了。
(2)该产品中碳酸钠的质量分数是否合格?___(要求写出计算过程,结果精确到0.1%)