题目内容
【题目】某校课外兴趣小组同学对有关镁与盐酸反应的系列研究:
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)实验时需将镁条进行打磨,其目的是_____。
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是_____反应,化学方程式为_____。
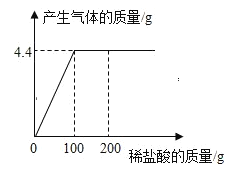
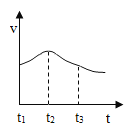
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间 内反应速率逐渐加快的主要原因是_____。
研究二:探究反应后所得溶液的酸碱性
(发现问题]
(1)反应后甲同学用 pH 试纸测定试管中溶液的酸碱性,发现 pH 小于 7。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色, 对此现象,乙同学重复如上实验,得到同样结果。
(提出猜想)甲同学:猜想Ⅰ:稀盐酸过量,使溶液 pH 小于 7;
猜想Ⅱ:氯化镁溶液 pH 小于 7. 乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色;
猜想Ⅱ:镁与热水反应使酚酞溶液变红色
(实践与思考)为验证猜想,甲乙两同学均需进行一个探究实验是_____. 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,同时还观察到镁条表面有气体生成.该气体能燃烧请你根据实验现象写 出镁与水反应的化学反应方程式_____。
(结论)(1)镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
(2)镁与稀盐酸反应,镁过量时所得溶液显碱性
(交流与反思)氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸 性,你认为与溶液中_____(填离子符号)。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,你认为原因可能是_____ 请设计实验验证你的猜想_____。
【答案】除去金属表面的氧化物(或污渍),防止干扰实验 放热 Mg+2HCl=MgCl2+H2↑ 镁与稀盐酸反应放热,溶液温度升高,化学反应速率变快 测定氯化镁溶液的酸碱性 Mg+2H2O=Mg(OH)2+H2↑ H+ 氢氧化镁的溶解度随着温度的降低而减小 取适量氢氧化镁固试管中,加入适量蒸馏水,滴入适量酚酞溶液,此时溶液为无色,用酒精灯加热试管,试管中的氢氧化镁固体逐渐溶解,溶液变为红;停止加热后,待试管冷却,观察到溶液中有固体析出,且溶液红色逐渐变淡
【解析】
探究一:(1)实验时需将镁条进行打磨,其目的是:除去金属表面的氧化物(或污渍),防止干扰实验;
(2)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,镁与稀盐酸反应产生氯化镁和氢气化学方程式为Mg+2HCl=MgCl2+H2↑。
(3)实验 测得镁片产生气体的速率(v)与时间(t)的关系如图所示,则 t1~t2 时间内反应速率逐渐加快的主要原因是:镁与稀盐酸反应放热,溶液温度升高,化学反应速率变快;
探究二:为验证猜想,甲乙对氯化镁溶液的酸碱性有争议,两同学均需进行一个探究实验是:测定氯化镁溶液的酸碱性; 乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很 快变为红色,说明溶液显碱性,同时还观察到镁条表面有气体生成.该气体能燃烧,该气体是氢气,则镁与热水反应产生氢氧化镁和氢气的化学反应方程式:Mg+2H2O=Mg(OH)2+H2↑
交流与反思:氯化钠溶液呈中性,而上述甲同学实验中镁完全反应后所得溶液显酸性,因为盐酸过量,与溶液中氢离子(H+)有关。
一段时间后,乙同学观察到溶液红色逐渐变淡,最后消失,原因可能是:氢氧化镁的溶解度随着温度的降低而减小,温度降低后,氢氧化镁固体析出,溶液的碱性变弱,红色变淡;
计实验验:取适量氢氧化镁固试管中,加入适量蒸馏水,滴入适量酚酞溶液,此时溶液为无色,用酒精灯加热试管,试管中的氢氧化镁固体逐渐溶解,溶液变为红;停止加热后,待试管冷却,观察到溶液中有固体析出,且溶液红色逐渐变淡。

【题目】(4分)KNO3和KCl在不同温度时的溶解度如下表所示。请回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是 。(填m或n)
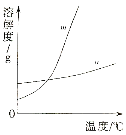
(2)由表中数据分析可知, KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是 。
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10
(4)如右图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的________(填字母序号)。
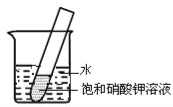
A.氢氧化钠固体 B.生石灰固体
C.冰块 D.硝酸铵固体
E.浓硫酸