题目内容
【题目】配平下列化学方程式
(1)_____Fe +___CuSO4 =___Cu +___FeSO4
(2)_____Al(OH)3+___H2SO4=___Al2(SO4)3+___H2O
(3)_____C3H8 +___O2 =___CO2 +___H2O
【答案】1 1 1 1 2 3 1 6 1 5 3 4
【解析】
根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可;配平时要注意化学计量数必须加在化学式的前面,配平过程中不能改变化学式中的下标;配平后化学计量数必须为整数。
(1)铁与硫酸铜反应产生硫酸亚铁和铜的化学方程式:Fe +CuSO4 = Cu + FeSO4;
(2)氢氧化铝与稀硫酸反应产生硫酸铝和水的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;
(3)丙烷在氧气中燃烧产生二氧化碳和水的化学方程式:C3H8 +5O2![]() 3CO2 +4H2O。
3CO2 +4H2O。

【题目】自热米饭是一种快餐食品。请根据下表中信息回答下列问题:

营养素 | 蛋白质 | 油脂 | 糖类 | 钠 | 钙 |
每份含量 | 29.6g | 23.5g | 104.7g | 814mg | 130mg |
(1)表中“自热米饭的营养成分”看,主要负责提供能量的是____,构成细胞的基本物质是____。没有标出的人体必须的营养素是______。
(2)菜肴包的包装材料是符合卫生标准的铝箔。铝可压制成铝箔,说明铝具有良好的_____性。铝是一种活泼的金属,请写出铝与稀硫酸反应的化学方程式__________。
(3)该自热米饭是利用生石灰与水反应放出的热量对菜肴进行加热的,生石灰与水反应的化学方程式为______,其基本反应是_______。
【题目】首届中国国际钢铁流通博览会以“困境与出路”为主题,将发展网上钢贸交易平台,钢材条形码有价格、产地等信息。则:
(1)生铁和钢是_____不同的两种铁合金,都属于_____(填“纯净物”或“混合物”)。
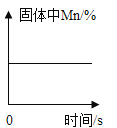
(2)为了探究铁与锰的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中的Mn元素显+2价)。请回答:
金属 | 铁 | 锰 |
分别与盐酸反应的现象 | 放出气泡速率缓慢 | 放出气泡速率较快 |
得出结论 | 得出活动性:铁_____(填“>”“<”)锰 | |
(3)写出锰与稀盐酸发生反应的化学方程式为____________,该反应的基本类型为____。
【题目】阅读下面科普短文。
苹果富含多种微量元素和维生素等人体所需的营养成分,有健脾开胃、补心益气的作用。常吃苹果还可以帮助降低胆固醇,提高免疫力。
表1 某苹果的主要营养成分(每100 g)
营养成分 | 糖类/g | 脂肪/g | 蛋白质/g | 维生素A/mg | 维生素C/mg | 钾/g | 钙/g | 铁/mg |
含量 | 16.21 | 0.17 | 0.26 | 3 | 4 | 0.12 | 0.04 | 0.6 |
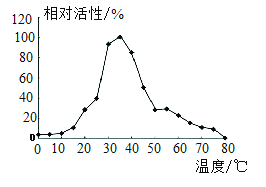
食用苹果时,应避免食用果核部分。因苹果籽中含有氰苷,氰苷在人体中易转化为剧毒物质氢氰酸(HCN)。苹果加工时容易褐变,影响外观、风味,还会造成营养流失。褐变主要是由于苹果中的酚类化合物在多酚氧化酶的催化下被氧化,因此,对于苹果中多酚氧化酶的特性研究就显得尤为重要(温度对富士苹果中多酚氧化酶相对活性的影响见图)。研究发现柠檬酸能较好地抑制苹果中多酚氧化酶的相对活性。
依据文章内容,回答下列问题:
(1)苹果在加工中发生的褐变属于_____变化(填“物理”或“化学”)。
(2)在日常食用苹果时应避免食用果核,因为苹果籽中的氰苷在人体内易转化为剧毒物质_____。
(3)由图1可知,多酚氧化酶的相对活性与温度的关系是_____。
(4)加工苹果时,加入_____可以抑制苹果的褐变。
(5)下列说法中,正确的是_____(填序号)。
A 苹果营养丰富,适量食用有益健康
B 高胆固醇人群不宜食用苹果
C 表1中的钾指的是钾元素
D 苹果中维生素C的含量高于蛋白质
【题目】实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】己知CuSO4也可作为过氧化氢分解的催化剂。写出其反应的符号表达式___________________________