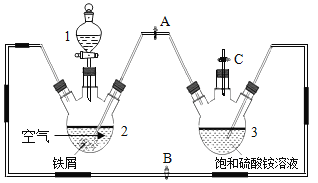
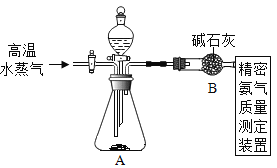
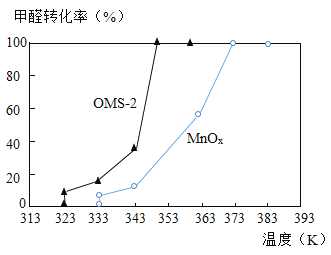
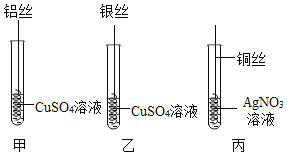
【题目】化学与社会、生活密切相关。
(1)扬州炒饭美味可口,下图为某饭店制作的原料表。制作“扬州炒饭”的主料中的米饭主要含的营养成分是_______ ,配料中能提供能量的营养成分是________ ,调料食盐中主要成分的化学式是_______ 。
主料 | 籼米饭、鲜鸡蛋 3—4 只 |
配料 | 海参、鸡腿肉、火腿、干贝、虾仁、花菇、鲜笋等 |
调料 | 食盐、植物油、味精 |
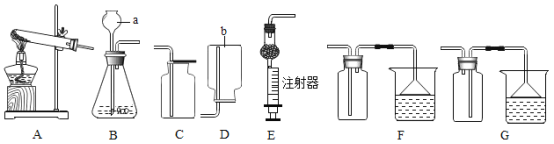
(2)豆浆机的使用方便了人们的生活,根据下图回答相关问题。

①豆浆机的制作材料中属于金属材料的是__________(填序号,下同),属于合成材料的是________ 。
②用铜作电源插孔是利用铜的_______ 性。
③传统的生豆浆是用石磨来研磨的,研磨的过程主 要是_______ 变化。
④将黄豆渣分离的方法类似于我们实验中的__________操作。
(3)“84消毒液”常用于公共场所杀菌消毒,其主要成分是次氯酸钠(NaClO),其中氯元素的化合价为________ ,消毒常用的漂白粉中有效成分为次氯酸钙,其化学式为_______ 。
(4)利用化学知识,可以防止生活中一些不良现象的产生。
①为了保证人身安全,进入久未开启的菜窖前,必须先做________ 实验。
②为防止照片褪色,可将照片塑封(用塑料薄膜封闭),目的是隔绝_______ 。
【题目】KNO3和NaCl的溶解度表及溶解度曲线如右图,下列说法错误的是 ( )
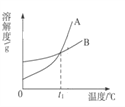
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度S/g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | |
A. t1介于20℃-40℃之间
B. 50℃时,溶液的溶质质量分数:KNO3 >NaCl
C. 当KNO3中混有少量NaCl时,可用降温结晶的方法提纯KNO3
D. 60℃时,30g KNO3加入50g水,充分溶解,再降温到20℃,会析出晶体14.2g