题目内容
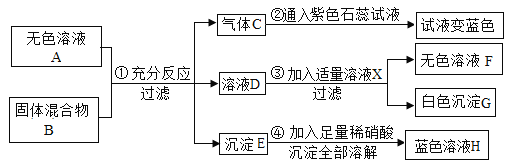
【题目】下图为某科研机构研究利用铁的氧化物循环裂解水蒸气制氢气的过程示意图。下列关于该过程的说法正确的是()
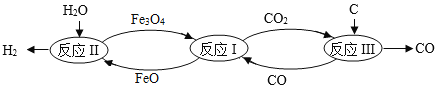
A.反应过程中需不断添加 Fe3O4 和 FeO
B.理论上,反应 II中每加入 18g水蒸气,会有 72gFeO 参加反应
C.反应过程中元素化合价发生改变的元素 Fe、C、H
D.整个过程的总反应方程式可以表示为:![]()
【答案】C
【解析】
A、分析流程图可知氧化亚铁是该反应的催化剂,所以理论上,不需要向体系中补充氧化亚铁,故A错误;
B、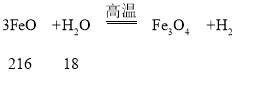
理论上,反应 II 中每加入18g水蒸气,会有216gFeO参加反应,故B错误;
C、该反应过程中,二氧化碳中碳的化合价是+4价,氧元素的化合价是-2价,氧气中氧元素的化合价是0,碳单质中碳元素的化合价为0,所以化合价改变的元素有C、O,氧化亚铁、四氧化三铁在反应中相互转化,所以反应过程中元素化合价发生改变的元素 Fe、C、H,故C正确;
D、通过分析可知,整个过程的总反应方程式可以表示为:H2O(气)+C H2+CO,故D错误。
H2+CO,故D错误。
故选:C。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4。
(查阅资料)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O![]() CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
CO2↑+CO↑+3H2O,碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
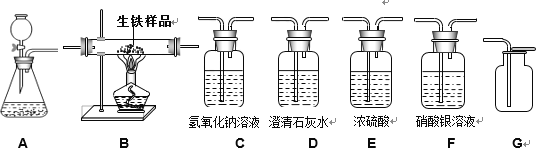
(问题讨论)为了测定铁红中铁元素的质量分数,小组间学进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是_____(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)写出E装置中所发生反应的一个化学方程式:_____。
(3)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则_____<m<_____。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是_____。
(实验反思)
(4)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会_____(选填“偏小”“不变”“偏大”)。
(5)该实验装置的一个明显缺陷是_____。