题目内容
【题目】氧锰八面体纳米棒(OMS-2)是一种新型的环保催化剂。用软锰矿和黄铁矿(主要成分分别为 MnO2、FeS2)合成 OMS-2 的工艺流程如下:
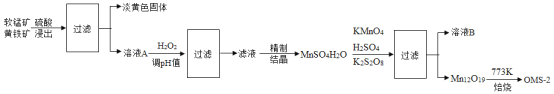
(1)为加快反应速率,软锰矿和黄铁矿需进行的预处理是________ 。
(2)淡黄色固体是一种非金属单质,化学式为_______。“调 pH 并过滤”主要除去________元素(写出元素名称)。
(3)Mn12O19 中氧元素化合价均为-2 价,锰元素的化合价有两种+3价和+4价,则显+3 价、+4 价的锰元素的原子个数之比为________。生产过程中的反应方程式如下并配平该方程式。其中化学方程式中 KMnO4、K2S2O8、MnSO4的化学计量数比为1:1:5。
_______ KMnO4+_______ K2S2O8+_______ MnSO4+_______ H2O=_______ K2SO4+_______ Mn12O19+_______ H2SO4
(4)确定 Mn12O19已洗净的方法为:取最后一次洗涤液,加入________,观察到现象为_______时,则已洗净。溶液 B 可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是_______;另一种为盐类,在农业生产中可用作_______ 。
(5)OMS-2 是一种纳米级的分子筛。分别用 OMS-2 和 MnOx 对甲醛进行催化氧化,在相 同时间内甲醛转化率和温度的关系如图:
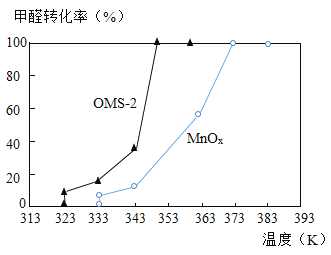
由图可知,OMS-2 与 MnOx 相比,催化效率较高是_______。(填“OMS-2”或“MnOx”)
【答案】将其粉碎 S 铁 5:1 2 2 10 11 3 1 11 硝酸钡溶液 没有白色沉淀生成 H2SO4 钾肥 OMS-2
【解析】
(1)为加快反应速率,可将软锰矿和黄铁矿粉碎,增大反应物的接触面积;故答案为:将其粉碎;
(2)根据质量守恒定律,化学反应前后,元素种类不变,可知,淡黄色非金属单质是硫,化学式为S;“调 pH 并过滤”主要除去铁元素。故填:S;铁;
(3)Mn12O19 中含有5个Mn2O3和2个MnO2,则显+3 价、+4 价的锰元素的原子个数之比为5×2:2=5:1;生产过程中的反应方程式配平如下:2KMnO4+2K2S2O8+10MnSO4+11H2O=3K2SO4+Mn12O19+11H2SO4;
故填:5:1;2;2;10;11;3;1;11.
(4)确定 Mn12O19已洗净的方法为:取最后一次洗涤液,加入硝酸钡溶液,观察到现象为没有白色沉淀生成时,则已洗净。溶液 B 可进一步分离出两种主要化合物,一种可在该工艺中循环使用,化学式是H2SO4;另一种为K2SO4,在农业生产中可用作钾肥。故填:硝酸钡溶液;没有白色沉淀生成;H2SO4;钾肥。
(5)由图可知,OMS-2 与 MnOx 相比,催化效率较高是OMS-2;故填:OMS-2。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案