题目内容
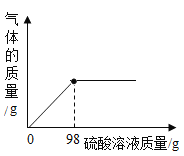
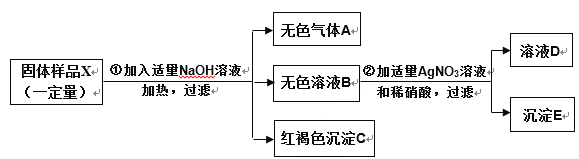
【题目】取 8g氢氧化钠固体,在空气中露置一段时间后,加入足量稀盐酸。充分反应后,下列说法正确的是()
A.氢氧化钠固体在空气中放置时间越久,反应中消耗的 HCl的质量越少
B.反应生成氯化钠的质量一定等于11.7g
C.氢氧化钠固体在空气中放置时间越久,固体中氧元素的质量分数越小
D.加入稀盐酸后,一定立即产生气泡
【答案】B
【解析】
根据氢氧化钠变质生成碳酸钠,以及氢氧化钠和碳酸钠都能与盐酸反应进行分析解答即可。
A、假设氢氧化钠全部变质,则根据反应的化学方程式可以看出:2NaOH+CO2═Na2CO3+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑,NaOH--HCl,即最终消耗的盐酸的量是不变的,错误;
B、8g氢氧化钠中钠元素的质量为8g×![]() ×100%=4.6g,反应生成氯化钠的质量一定等于:
×100%=4.6g,反应生成氯化钠的质量一定等于: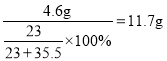 ,正确;
,正确;
C、假设氢氧化钠全部变质,最终变成碳酸钠,氢氧化钠中氧元素的质量分数为:![]() ×100%=40%,而碳酸钠中氧元素的质量分数为:
×100%=40%,而碳酸钠中氧元素的质量分数为:![]() ×100%≈45.3%,故氧元素的质量分数是增大的,错误;
×100%≈45.3%,故氧元素的质量分数是增大的,错误;
D、由于可能含有氢氧化钠,故加入盐酸不一定立即产生气泡,错误;
故选:B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目