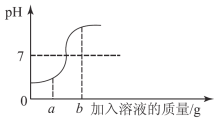
【题目】一些食物的近似pH如下:
食物 | 葡萄汁 | 苹果汁 | 牛奶 | 鸡蛋清 |
pH | 3.5~4.5 | 2.9~3.3 | 6.3-6.6 | 7.6~8.0 |
下列说法正确的是
A. 鸡蛋清和牛奶显碱性 B. 要补充维生索可以多吃鸡蛋清
C. 苹果汁的酸性比葡萄汁弱 D. 胃酸过多的人应少饮葡萄汁和苹果汁
【题目】某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动并回答相关问题。
(查阅资料)天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质—水垢(主要成分为碳酸盐和碱。有关物质的溶解性见下表:
阴离子 阳离子 | OH- | CO32- | HCO3- |
Ca2+ | 微溶 | 不溶 | 可溶 |
Mg2+ | 不溶 | 微溶 | 可溶 |
(提出猜想)水垢的主要成分一定有CaCO3和_____(填化学式),可能含有Ca(OH)2和______。
(提出问题)水垢的主要成分中是否含有Ca(OH)2和MgCO3呢?
(设计方案1)确定水垢中是否含Ca(OH)2
实验步骤 | 实验现象 | 结论 |
在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液。 | ______________ | 一定不含Ca(OH)2 |
(实验方案2)确定水垢中是否含MgCO3
利用下列实验装置,完成实验2探究。其主要实验步骤如下:

其主要实验步骤如下:称量D、E装置总质量为200.0g,按上图组装后,将2.5g水垢试样放入锥形瓶中,加入足量稀盐酸溶液,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为201.25g(碱石灰主要成分为CaO和NaOH,不考虑稀盐酸的挥发性以及装置内空气、外界空气对实验的影响)。
(实验讨论)
(1)反应结束后打开止水夹K,缓缓鼓入空气的目的是_____A、B装置之间_____设置干燥装置。(填“要”或“不要”)其理由是______
(2)装置B盛放稀盐酸的仪器作用是:______
(3)装置 B中生成气体的反应的化学方程式为______
(4)装置B中生成气体的质量为______g通过计算说明该水垢中____(填序号)含MgCO3。
A 一定 B 一定不 C 可能 D 无法确定
已知CaCO3相对分子质量为100.Mg CO3相对分子质量为84):
(实验方案3)确定水垢中是否含有Mg(OH)2
(5)另取质量为1.2g的水垢试样,加入3.65%稀盐酸与之恰好完全反应,测得消耗稀盐酸mg。合上述实验,判断当m的值满足_____条件时,水垢中一定含有Mg(OH)2
【题目】化工厂用废硫酸制备K2SO4的流程如下:
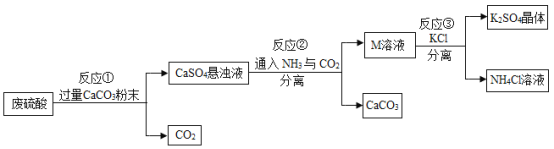
(1)生产上将CaCO3研成粉末的目的是_______欲达此目的,还可采用的方法是__________ (任写一条)
(2)上述流程中,还可循环使用的物质是___(填写化学式).
(3)写出反应①中主要的化学方程式_______
(4)反应③中相关物质的溶解度如下表所示,反应③在常温下可实现的原因是______
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(5)洗涤反应③所得晶体最适宜的试剂是___________ (填序号)
A H2O B 饱和K2SO4溶液 C 二者均可
(6)检验K2SO4晶体是否洗涤干净的方法是 ____________