【题目】某化学兴趣小组对生铁的冶炼和性质非常感兴趣。同学们称取了20g生铁样品,放在质量为10.0g的烧杯中,将20g稀盐酸分4次加入烧杯中。在化学反应过程中对烧杯(包括溶液和固体)进行了五次称量,记录如下表:
加酸质量/g | 5 | 5 | 5 | 5 |
反应后烧杯和药品质量/g | 34.8 | 39.6 | 44.4 | 49.3 |
(1)样品完全反应产生H2的质量是____克,这种样品中铁的含量是___?(精确到0.1%)
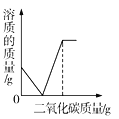
(2)请在坐标中画出相应的曲线图_____(纵坐标为生成物的质量,请设定具体物质;并标出曲线中必要的数据)。

(3)请解释生铁与盐酸反应过程速度由快变慢的原因是____。
(4)生铁可以由一氧化碳还原铁矿石得到。同学们在实验室用CO和Fe2O3隔绝空气加强热模拟炼铁过程(密闭容器中),一段时间后收集到如下数据:
物质 | CO | Fe2O3 | Fe | M | CO2 |
反应前质量(g) | 2.8 | 16 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 0 | a | b |
CO
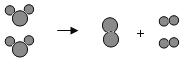
【题目】小金和小平两位同学进行“如图”两个实验。
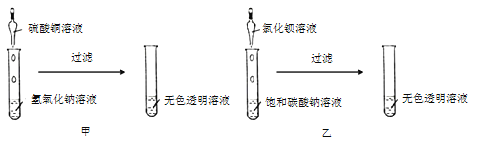
(l)甲实验中反应的化学方程式为_________;
(2)乙实验观察到的现象_____。
(3)实验结束后,两位同学把实验后的两支试管的溶液倒入同一个烧杯中,烧杯中没有明显现象,他们决定对溶液溶质成分进行探究。
(提出问题)烧杯中溶液的溶质成分是什么?
小金认为溶液的溶质一定有Na2SO4;小平认为溶液的溶质一定有____;溶质中还可能有什么?
(进行猜想)小金认为溶液的溶质可能有Na2CO3; 小平认为溶液的溶质可能有____;我认为溶液的溶质可能Na2CO3和NaOH都有。
(验证猜想)
实验操作 | 现象 | 结论 |
①取少量烧杯中的溶液于试管,测定pH。 | pH>7 | 溶液呈____性 |
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,静置,再滴加无色酚酞。 | ____,溶液由无色变为红色。 | 我的猜想成立 |
(结论分析)小区认为实验操作②的结论不严谨,因为___;若要确定我的猜想是否成立,应另取少量烧杯中的溶液于试管中,滴加___,然后观察是否有___出现,反应的方程式为___。
(拓展与思考)如果实验操作①中测得的pH=7,烧杯中溶液的溶质成分是____;可见,探究反应后所得物质的成分时,既要考虑生成物,还要考虑反应物是否过量。