题目内容
【题目】某化学兴趣小组对生铁的冶炼和性质非常感兴趣。同学们称取了20g生铁样品,放在质量为10.0g的烧杯中,将20g稀盐酸分4次加入烧杯中。在化学反应过程中对烧杯(包括溶液和固体)进行了五次称量,记录如下表:
加酸质量/g | 5 | 5 | 5 | 5 |
反应后烧杯和药品质量/g | 34.8 | 39.6 | 44.4 | 49.3 |
(1)样品完全反应产生H2的质量是____克,这种样品中铁的含量是___?(精确到0.1%)
(2)请在坐标中画出相应的曲线图_____(纵坐标为生成物的质量,请设定具体物质;并标出曲线中必要的数据)。

(3)请解释生铁与盐酸反应过程速度由快变慢的原因是____。
(4)生铁可以由一氧化碳还原铁矿石得到。同学们在实验室用CO和Fe2O3隔绝空气加强热模拟炼铁过程(密闭容器中),一段时间后收集到如下数据:
物质 | CO | Fe2O3 | Fe | M | CO2 |
反应前质量(g) | 2.8 | 16 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 0 | a | b |
CO
【答案】0.7 98% 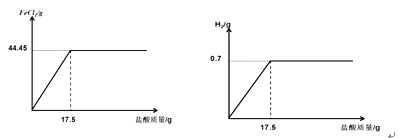 随着盐酸被消耗,盐酸中溶质质量分数减小,所以反应速度由快变慢 4.4g FeO
随着盐酸被消耗,盐酸中溶质质量分数减小,所以反应速度由快变慢 4.4g FeO
【解析】
(1)根据质量守恒定律可得,样品完全反应后生成H2的质量=20g+10g+20g-49.3g=0.7g;
设:生成0.7g的氢气需铁的质量为x,同时生成氯化亚铁的质量为y。
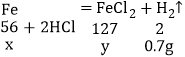
![]() x=19.6g;
x=19.6g;
![]() y=44.45g;
y=44.45g;
样品中铁的含量=![]() ;
;
(2)根据题意可知,每5g盐酸能产生的氢气质量=20g+10g+5g-34.8g=0.2g;
设:产生0.7g氢气需盐酸的质量为z。
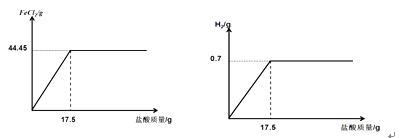
![]() z=17.5g;
z=17.5g;
该反应没有加入盐酸时,氯化亚铁、氢气的质量为零,随盐酸的加入,反应的生成的氯化亚铁、氢气的质量逐渐增大,当加入盐酸17.5g时,铁完全反应,氯化亚铁、氢气质量不再增大,最终产生的氯化亚铁质量为44.45g,氢气的质量为0.7g。图像如图:
(3)生铁与盐酸反应过程速度由快变慢的原因是随着盐酸被消耗,盐酸中溶质质量分数减小,所以反应速度由快变慢;
(4)生成的二氧化碳的质量为m,由元素质量守恒可知:
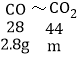
![]() 解得:m=4.4g
解得:m=4.4g
Fe2O3中铁元素的质量为![]()
生成的M中氧元素的质量为:![]() ;
;
生成的M中铁原子、氧原子的个数比为:![]() ,所以物质M的化学式为FeO。表中b的值为4.4;物质M的化学式为FeO。
,所以物质M的化学式为FeO。表中b的值为4.4;物质M的化学式为FeO。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案