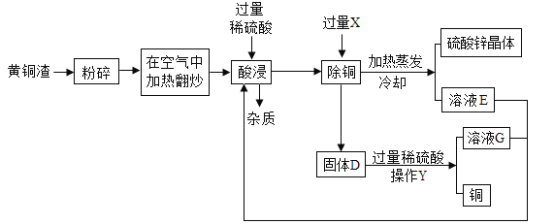
题目内容
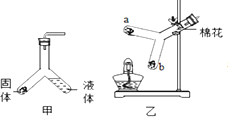
【题目】小金和小平两位同学进行“如图”两个实验。
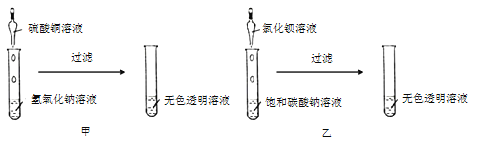
(l)甲实验中反应的化学方程式为_________;
(2)乙实验观察到的现象_____。
(3)实验结束后,两位同学把实验后的两支试管的溶液倒入同一个烧杯中,烧杯中没有明显现象,他们决定对溶液溶质成分进行探究。
(提出问题)烧杯中溶液的溶质成分是什么?
小金认为溶液的溶质一定有Na2SO4;小平认为溶液的溶质一定有____;溶质中还可能有什么?
(进行猜想)小金认为溶液的溶质可能有Na2CO3; 小平认为溶液的溶质可能有____;我认为溶液的溶质可能Na2CO3和NaOH都有。
(验证猜想)
实验操作 | 现象 | 结论 |
①取少量烧杯中的溶液于试管,测定pH。 | pH>7 | 溶液呈____性 |
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,静置,再滴加无色酚酞。 | ____,溶液由无色变为红色。 | 我的猜想成立 |
(结论分析)小区认为实验操作②的结论不严谨,因为___;若要确定我的猜想是否成立,应另取少量烧杯中的溶液于试管中,滴加___,然后观察是否有___出现,反应的方程式为___。
(拓展与思考)如果实验操作①中测得的pH=7,烧杯中溶液的溶质成分是____;可见,探究反应后所得物质的成分时,既要考虑生成物,还要考虑反应物是否过量。
【答案】2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 有白色沉淀(溶液变浑浊) NaCl NaOH 碱 有白色沉淀(溶液变浑浊) 烧杯溶质中一定有Na2SO4,没有Na2CO3也有相同的现象 足量的稀盐酸(其它酸也可) 气泡 Na2CO3+2HCl==2NaCl+H2O+CO2↑ NaCl和Na2SO4(或氯化钠和硫酸钠)
【解析】
(l)甲实验中氢氧化钠和稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4;
(2)乙实验中,氯化钡和碳酸钠反应生成白色沉淀碳酸钡和氯化钠,观察到有白色沉淀(溶液变浑浊);
(3)提出问题:
小金认为溶液的溶质一定有氢氧化钠和硫酸铜反应生成的Na2SO4;
小平认为溶液的溶质一定有碳酸钠和氯化钡反应生成的氯化钠;
进行猜想:
小金认为溶液的溶质可能有Na2CO3;小平认为溶液的溶质可能有过量氢氧化钠;
我认为溶液的溶质可能Na2CO3和NaOH都有;
验证猜想:
①取少量烧杯中的溶液于试管,测定pH大于7,说明溶液显碱性;
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,产生白色沉淀,静置,再滴加无色酚酞,溶液变红色,说明溶液中含有氢氧化钠,实验过程如下所示:
实验操作 | 现象 | 结论 |
①取少量烧杯中的溶液于试管,测定pH。 | pH>7 | 溶液呈碱性 |
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,静置,再滴加无色酚酞。 | 有白色沉淀(溶液变浑浊),溶液由无色变为红色。 | 我的猜想成立 |
结论
硫酸钠能和氯化钡反应生成白色沉淀硫酸钡和氯化钠。小区认为实验操作②的结论不严谨,烧杯溶质中一定有Na2SO4,没有Na2CO3也有相同的现象;
若要确定我的猜想是否成立,应另取少量烧杯中的溶液于试管中,滴加足量的稀盐酸(其它酸也可),然后观察是否有气泡出现,如果产生气泡,是因为碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳气体,反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
拓展与思考:
如果实验操作①中测得的pH=7,说明溶液显中性,烧杯中溶液的溶质成分是NaCl和Na2SO4(或氯化钠和硫酸钠)。

 阅读快车系列答案
阅读快车系列答案