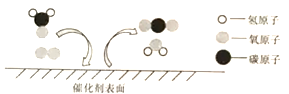
题目内容
【题目】已知:CO2+H2O+CaCO3=Ca(HCO3)2,下列图像表示将CO2气体缓缓通入到一定质量的饱和石灰水中某些量随通入CO2质量的变化趋势,其中不正确的是
A. 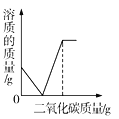 B.
B. 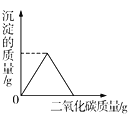
C. 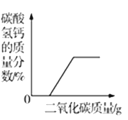 D.
D. 
【答案】D
【解析】
A、CO2气体缓缓通入到一定质量的饱和石灰水,二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,氢氧化钙的逐渐减少,氢氧化钙完全反应后,溶液中的溶质为零;随着二氧化碳的继续通入,二氧化碳、水和碳酸钙反应生成可溶的碳酸氢钙,溶液中溶质的质量逐渐增大,当碳酸钙完全消耗后,溶液中溶质质量不变,图像与事实相符,故A正确;
B、向澄清石灰水中持续通入CO2,二氧化碳与石灰水反应生成碳酸钙沉淀,随着二氧化碳的通入开始沉淀质量不断增大;完全沉淀后,二氧化碳在水中会继续与碳酸钙反应生成可溶性的碳酸氢钙,沉淀又消失,图像与事实相符,故B正确;
C、CO2气体缓缓通入到一定质量的饱和石灰水,二氧化碳与氢氧化钙反应生成碳酸钙和水,不产生碳酸氢钙,碳酸氢钙的质量为零,随着二氧化碳的通入,二氧化碳、水和碳酸钙反应生成可溶的碳酸氢钙,溶液中溶质的质量逐渐增大,当碳酸钙完全消耗后,溶液中溶质质量不变,图像与事实相符,故C正确;
D、CO2气体缓缓通入到一定质量的饱和石灰水,二氧化碳与氢氧化钙反应生成碳酸钙和水,随着反应的进行,氢氧化钙的逐渐减少,氢氧化钙完全反应后,溶液质量为零;随着二氧化碳的继续通入,二氧化碳、水和碳酸钙反应生成可溶的碳酸氢钙,溶液的质量逐渐增大,当碳酸钙完全消耗后,溶液质量不变,图像与事实不符,故D错误。故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目