��Ŀ����
����Ŀ��������ҵ��һ�����ҹ�ҵ����չ��֧����ҵ����ͼ��ʵ���Һ�ҵ������ʾ��ͼ��ijѧУ���á�����̽��ʽ"���ý�ѧ���Ӷ�������⡣�����������������⡣
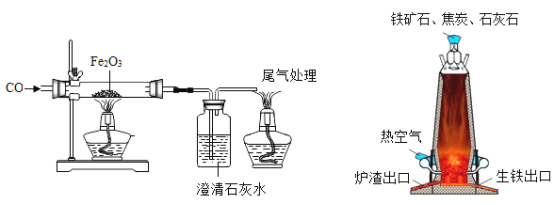
��1��ʵ��ʱ���ȸ���Ʒ���ȣ���ͨһ����̼���ܲ����ĺ����_______��
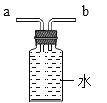
��2���������β��������ԭ����___��С��ͬѧ��Ϊβ�����ȴ�����ƿ�ڣ�Ȼ���ٴ�������ͼ������Ƶ�����ƿ,a��b����Ӧ������룬�뽫ͼ��������(β����a��ͨ��) __��
��3��С��ͬѧ�������:CO�ܷ�ʹ����ʯ��ˮ�����?��ˣ��������COͨ�벣����֮ǰ��Ӧ��ͨ�����ʯ��ˮ�����ų�CO�����ʯ��ˮ�ķ�Ӧ���ԶԴ��������ۡ�����ΪС��ͬѧ�����___________(��"��"��û��")��Ҫ��������___;β���ܹ�ʹ����ʯ��ˮ����ǵķ�Ӧԭ����__��
��4����ҵ�����н�̿��������__
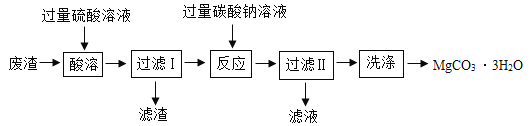
��5���ֽ�40 t��������80%������ʯ������һ����̼��ַ�Ӧ �������Ͽɵõ����������Ƕ���__?
���𰸡���ը һ����̼�ж�������ɴ�����Ⱦ  û�� �ڼ���ǰ����ͨ����һ����̼������ʱһ����̼��ʯ��ˮ�Ѿ���ֽӴ�
û�� �ڼ���ǰ����ͨ����һ����̼������ʱһ����̼��ʯ��ˮ�Ѿ���ֽӴ� ![]() �ṩ������һ����̼ 22.4t
�ṩ������һ����̼ 22.4t
��������
��1��ʵ��ʱ����װ������������һ����̼���п�ȼ�ԣ����ȸ����������ȣ���ͨһ����̼���ܲ����ĺ���DZ�ը��
��2������һ����̼�ж�������Ӧ��β����������Ҫԭ����һ����̼�ж�������ɴ�����Ⱦ�������Ǵ���ƿ������������ƿ�ڶ�Һ�屻ѹ��������a��b����Ӧ����ͼ ��
��
��3��û��Ҫ���������ڼ���ǰ����ͨ����һ����̼������ʱһ����̼��ʯ��ˮ�Ѿ���ֽӴ���
��5����ҵ�����н�̿�������ǣ��ڸ����£���̿��������Ӧ���ɶ�����̼���ų���������̿�ٰѶ�����̼��ԭ��һ����̼��β���ܹ�ʹ����ʯ��ˮ���������Ϊ������̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ����Ӧ�Ļ�ѧ����ʽ��![]() ��
��
��6��������Ԫ����������ɵã����ɵ�������Ϊ40t��80%��![]() ��100%=22.4t��
��100%=22.4t��

 �Ķ��쳵ϵ�д�
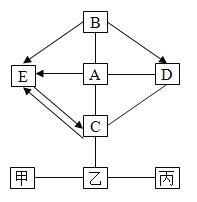
�Ķ��쳵ϵ�д�����Ŀ�����и���ת����ϵ�еķ�ӦΪ���л�ѧ�����ķ�Ӧ,���еġ�������ʾij�����ʿ�һ����Ӧ������һ�����ʡ��ס��ҡ����������ʲ����϶�Ӧ��ת����ϵ�����ǣ� ��
ѡ�� | A | B | C | D | |
ת����ϵ |
|
|
|
| |
���� | �� | H2O2 | C | CaCO3 | FeCl2 |
�� | O2 | CO | CO2 | Fe | |
�� | H2O | CO2 | Na2CO3 | Fe2O3 | |
A.AB.BC.CD.D
����Ŀ����ش��������⣺
��1�����ȷ�Ӧ�Ǻ�����·�ϸֹ�ķ�Ӧԭ�������ڸ���������������������Ӧ����������������д���÷�Ӧ�Ļ�ѧ����ʽ_____�÷�Ӧ����_____��Ӧ����������ͣ�
��2�������Dz��ֽ����IJ����������ʣ�
�������� | �������ʱȽ� |
������ |
|
�ܶ� |
|
���ϱ���֪���������߿յ�������Ϊ_____��_____��
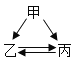
��3������۲�����Ƚ����м�����Ӧ������
A ������»��������ڸ�����Ҳ��������������Ӧ��Au+O2![]() ������Ӧ��
������Ӧ��
B ����þ�ڿ�����ȼ�գ�����ҫ�۵�ǿ�⣬�ų�������������2Mg+O2![]() 2MgO
2MgO
C ͭ�ڼ���������������������Ӧ���ڱ����ڡ�2Cu+O2![]() 2CuO
2CuO
D ���ڿ�����������������Ӧ���ڱ�������һ�����ܵ�����Ĥ��2Al+3O2=2Al2O3
������ʵ����ʵ���Կ��������ֽ����Ļ��˳����_____��