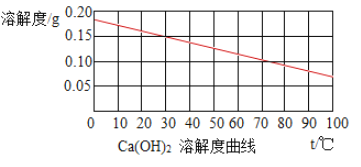
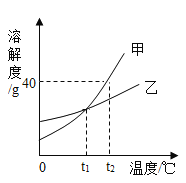
��Ŀ����
����Ŀ��ʵ�������ֹ�ҵ����(��Ҫ�ɷ�ΪMgCO3��MgO��SiO2)Ϊԭ���Ʊ�:MgCO3��3H2O.����Ҫʵ��������ͼ, ��֪: SiO2������ˮ�������²������ᡢ̼���Ʒ�Ӧ��MgCO3������ˮ���������ᷴӦ��
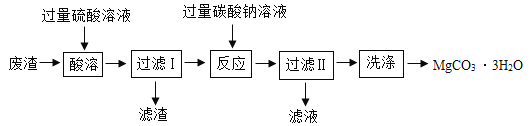
��1��Ϊ�˼ӿ�����������������ʣ��ɲ��õİ취��____ (��дһ��)������ʱ�õ��IJ���������:�ձ���©����_____��
��2���������̼������Һ��Ӧ�Ļ�ѧ����ʽΪ_____��_____��
��3��������II��������Һ�к��е���Ҫ������_____(�����ӷ���)��
��4������Ӧ������ǰ����й��ˣ��ܷ�ʡȥ������I��ֻ����������II����___ ( ����������������)��������_____��
��5����������ʱ����������Һ���˹���̫���ԭ����_____��
���𰸡��������£����裻 ��������Ũ�� ������ Na2CO3+H2SO4=Na2SO4+H2O+CO2�� Na2CO3 +MgSO4 =Na2SO4+MgCO3�� Na+��![]() ��
��![]() �� ���²�Ʒ����(��ʹ��Ʒ�к�������SiO2(����Ҳ��) �����Ʊ���Ʒʱ���ĸ����̼����(�����Ĵ�����̼����) (����Ҳ��)
�� ���²�Ʒ����(��ʹ��Ʒ�к�������SiO2(����Ҳ��) �����Ʊ���Ʒʱ���ĸ����̼����(�����Ĵ�����̼����) (����Ҳ��)
��������
��1���������¡����衢��������Ũ�ȣ����Լӿ�����������������ʣ�����ʱ�õ��IJ��������У��ձ���©����������������������¡����衢��������Ũ�ȣ���������
��2�������ܡ�ʱ����þ�Լ�̼��þ�����ᷴӦ����Ӧ�Ļ�ѧ����ʽΪMgO+H2SO4= MgSO4+H2O��MgCO3+H2SO4=MgSO4+H2O+CO2���������̼���ƺ�̼���ƺ�����þ��Ӧ����̼��þ�����������ƣ������ᷴӦ���������ƶ�����̼��ˮ����ѧ����ʽΪNa2CO3+H2SO4=Na2SO4+H2O+CO2����Na2CO3 +MgSO4 =Na2SO4+MgCO3�������Na2CO3+H2SO4=Na2SO4+H2O+CO2����Na2CO3 +MgSO4 =Na2SO4+MgCO3����
��3������II������Һ�к��й���̼���ƺ������ƣ���Ҫ������Na+��![]() ��
��![]() �����Na+��
�����Na+��![]() ��
��![]() ��
��
��4������ʡȥ������I��ֻ���С���ҺII������Ϊ�������費����ˮ�������²������ᡢ̼���Ʒ�Ӧ�����ʡ�ԡ�����I�����ᵼ�µõ��IJ�Ʒ��Ϊ���ж�������������������
��5��������������Ҫ����̼���ƽ��г���,���ԡ����ܡ�ʱ����������Һ���˹���̫���ԭ���DZ����Ʊ���Ʒʱ���ĸ����̼���ƣ���������Ʊ���Ʒʱ���ĸ����̼���ơ�

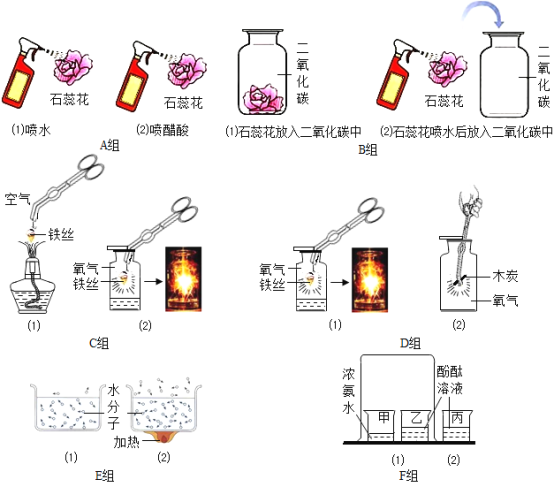
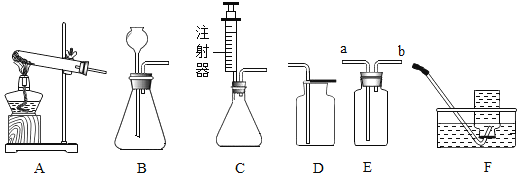
����Ŀ���Ա�������������Ŀ�ѧ�����������������ͼA��F�����飬����±�ʵ����ƣ�
ʵ����� | ̽��Ŀ�� | ѡ�öԱ�ʵ�飨������ţ� |
1 | ��ͬ���¶ȣ��Է����˶���Ӱ�� | __ |
2 | __ | C�� |
3 | �����CO2�ܷ�ʹʯ���� | __ |