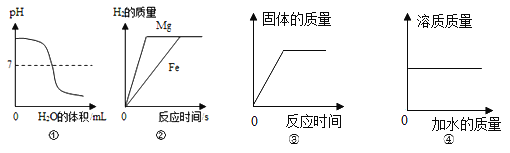
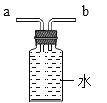
��Ŀ����
����Ŀ����ͼ�е�����Ϊ���л�ѧ�������ʣ�����֮��ķ�Ӧ��ϵ��ͼ��ʾ(��������ʾת����ϵ����������ʾ��ܷ�Ӧ�����ַ�Ӧ��������Ӧ��������ȥ)������A��Һ��Ӧ�õ�dz��ɫ��Һ��A��B�����кͷ�Ӧ������֮һ�dz����ڳ��õĵ�ζƷ��C�����ڸ���������������C����Һ��D����Һ��Ӧ�ɵõ�B��C����Һ���ҵ���Һ��Ӧ������ɫ�����������������Һ��Ӧ�������ֲ�ͬ��ɫ�ij�������ش�
(1)�Ļ�ѧʽ��_____��D�Ļ�ѧʽ��_____��
(2)��ͨ��ʵ������۲�A��B�Ƿ�ǡ����ȫ��Ӧ��ʵ��ǰ��Ҫ��B��Һ�м�����Լ���_____��
(3)E��C��Ӧ�Ļ�ѧ����ʽ��_____��
(4)�����������Һ��Ӧ�Ļ�ѧ����ʽ��_____��
���𰸡�Fe Na2CO3 ��̪��Һ CaO+H2O=Ca(OH)2 CuSO4+Ba(OH)2=Cu(OH)2��+BaSO4��
��������
����A��Һ��Ӧ�õ�dz��ɫ��Һ��A��B�����кͷ�Ӧ������֮һ�dz����ڳ��õĵ�ζƷ����A��B�����кͷ�Ӧ�������Ȼ��ƣ�����ΪA�ͼ�Ӧ����dz��ɫ��Һ������������Ӧ�����Ȼ��������������������������ᷴӦ�����Ȼ��ƺ�ˮ�����A��ϡ���ᣬ��������B���������ƣ��������Ƴ����ڸ����������������C���������ƣ����������ܺ�̼���Ʒ�Ӧ����̼��Ƴ������������ƣ�̼�����ܺ�ϡ���ᷴӦ�����������ܺͶ�����̼��Ӧ����̼���ƣ����D��̼���ƣ�����������Һ���ҵ���Һ��Ӧ������ɫ������˵�����к���ͭ���ӣ������������Һ��Ӧ�������ֲ�ͬ��ɫ�ij������ɴ˿�֪��������ͭ����������������������Ϊ����ͭ������������Ӧ���ɰ�ɫ�������ᱵ����ɫ����������ͭ���������ƺͶ�����̼�ܹ�����ˮ��ϡ������������Ʒ�Ӧ�ܹ�����ˮ���������ƺͶ�����̼��Ӧ�����ܹ�����ˮ�����E��ˮ�������������֤��������ȷ��
�������Ϸ�����֪��
��1���Ļ�ѧʽ��Fe��D�Ļ�ѧʽ��Na2CO3��
��2����ͨ��ʵ������۲�A��B�Ƿ�ǡ����ȫ��Ӧ��ʵ��ǰ��Ҫ��B��Һ�м�����Լ��Ƿ�̪��Һ��������Ϊ����������Һ�м����̪��Һʱ����Һ���ɫ������ϡ����ĵμӣ��������ƺ�ϡ���ᷴӦ������ɫ�ո���ʧʱ��˵���������ƺ�ϡ����ǡ����ȫ��Ӧ��
��3��ˮ�ܺ������Ʒ�Ӧ�����������ƣ���Ӧ�Ļ�ѧ����ʽΪ��CaO+H2O=Ca(OH)2��
��4������ͭ������������Ӧ���ɰ�ɫ�������ᱵ����ɫ����������ͭ����Ӧ�Ļ�ѧ����ʽΪ��CuSO4+Ba(OH)2=Cu(OH)2��+BaSO4����

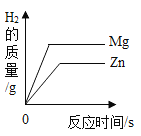
����Ŀ���ӷ������ϼ���6g��Ƭ�����汻�������Һ��в����ᷴӦ�����ʣ������ձ��С���100gϡ�����5�μ����ձ��С�����ձ������ʵ������仯���±���ʾ��
��1�� | ��2�� | ��3�� | ��4�� | ��5�� | |
�����������/g | 20 | 20 | 20 | 20 | 20 |
�ձ��е�����/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
��1����5�μ���ϡ����ʱ���ձ���������
��2������Ƭ�������ʵ�����������
��3������ͼ�л�������H2������������ϡ�����������ϵ��
��4���ѱ���������ռδ������ǰ��Ƭ������������ ��
����Ŀ����ѧ��ȤС�����ô����������ݲɼ���������ģ�⽨�������ֳ�������������������̼Ũ�Ⱥ��¶ȵı仯����֤���������������Եĺ����ԡ���ͼ1��ʾ������ԲͲ�������ײ�3����(K1��K2��K3)�ֱ���üס��ҡ���3֧�ߵͲ�ͬ��������ͼ2��ʾ����ÿ֧��оһ�����붼���η�������������(a1��a2��a3)���¶ȴ�����(b1��b2��b3)�Ͷ�����̼������(c1��c2��c3)����ȼ�������ʵ���������Ǻɼ�ÿ֧������渽��������ݡ�
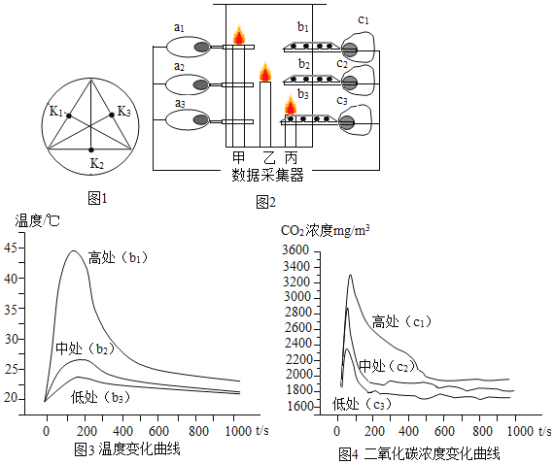
(1)ʵ���ȡ3֧����Ϩ���ʱ�����1��ʾ������ȡÿ֧������������ʱ��ʱ���渽���ĺ��������2��ʾ��
��1 3֧����Ϩ���ʱ��
���� | �� | �� | �� |
Ϩ��ʱ��/s | 106 | 164 | 199 |
��2 Ϩ��ʱ��ͬ�߶�����ĺ�����% | |||
Ϩ��ʱ��/s | �ʹ�(a1) | �д�(a2) | �ߴ�(a3) |
106 | 19.8 | 19.1 | 18.5 |
164 | 18.9 | 17.7 | x |
199 | 18.6 | 17.1 | 16.5 |
�پݱ�l������3֧����Ϩ����Ⱥ�˳����_____��
�ڱ�2�У�x������_____(�����)
A 179 B 172 C 161
������Ϩ��ʱ������������Ϊ�㡣��ݴ˶�ȼ�������ı�������һ�����Ż�____��
���ݿ���2���ݣ�_____(ѡ������������������������)�����������½�������
(2)ʵ���ȡ�¶ȺͶ��Ȼ�̼Ũ����ʱ��仯����������ͼ3��ͼ4��ʾ��
�ɴ˿�֪����ȼ����������̼Ũ���ɵʹ����ߴ���______��ԭ����______��
(3)�����Ϸ�������������ʱ����ԱӦ����������ǽ�ڻ���������������������____��
����Ŀ��ijѧϰС������ʵ���������ÿ�����þ��Ϊԭ����ȡ��������þ��Mg3N2�����������Ͽ�֪ Mg��Mg3N2�ܷ������·�Ӧ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]()
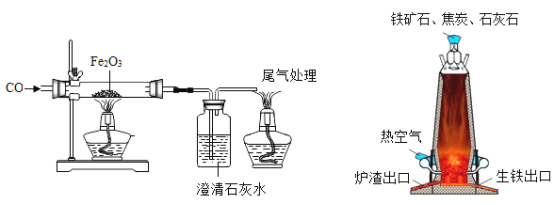
ʵ�������õ�װ�ú�ҩƷ��ͼ��ʾ��þ�ۡ���ԭ���۾��Ѹ��װ�����������ķ�Ӧ����ȫ�ģ�����װ�õ�ĩ�����������������ش��������⣺
��1�����Ӳ����ʵ��װ�õ������ԣ�ʵ�鿪ʼʱ��������ͨ��ʵ��װ�ã�����������װ�õ�˳����_____����װ����ţ���Dװ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
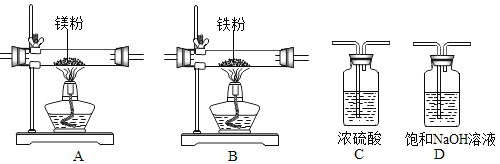
��2��ͨ����Ӧ�ȵ�ȼ_____���A����B����װ�õľƾ��ƣ����ͬʱ��ȼA��Bװ�õľƾ��ƣ���ʵ�����к�Ӱ�죿_____��
��3�����һ��ʵ�飬��֤�����ǵ���þ��
ʵ�������ʵ������ | ʵ����� |
_____ | �����ǵ���þ |
��4��˼ά��չ��������N2�ĺ���Զ����O2�ĺ�������þ���ڿ�����ȼ�����ɵ�MgO������ȴԶ����Mg3N2������������������Ľ���_____��