题目内容
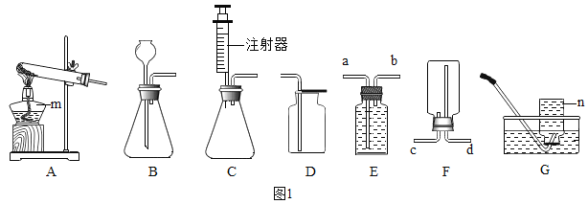
【题目】某某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1______t2(填“>”“=”“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是__________。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
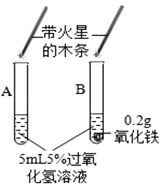
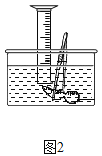
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
小组的同学认为要证明Fe2O3是催化剂,上述二个实验还不够,还需要再增加一个实验,
a、该实验的目的是:____________
b、请你设计实验证明,简要的写出实验步骤及实验现象:_________。
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
【答案】< ③④ 其他条件相同,溶质质量分数越大,过氧化氢分解越快 加快 称量 探究反应前后Fe2O3的化学性质是否改变 取操作B的滤渣于试管中加入过氧化氢溶液;产生大量气泡(或待操作的B试管反应结束后,继续加入过氧化氢溶液;产生大量气泡)
【解析】
Ⅰ.(1)对比①②可知,其他条件均相同,②实验温度较高,过氧化氢分解较快,因此t2所需时间较短;
(2)③④两组实验唯一的不同是过氧化氢溶液溶质质量分数不同,因此能得出过氧化氢分解快慢与溶质质量分数有关;能得出的合理结论是:其他条件相同时,H2O2溶液的溶质质量分数越高,过氧化氢分解越快;
Ⅱ.①AB两组实验唯一区别是B组实验加了氧化铁,结果A试管上方带火星的木条未复燃,B中出现气泡快带火星的木条复燃,由此能得出Fe2O3加快过氧化氢分解;
②由于实验得出的结论是Fe2O3质量未变,由此该实验操作为称量;
③a、还必须在增加一个实验:探究Fe2O3的化学性质在反应后是否改变;只有Fe2O3具备既能改变化学反应速率,其质量和化学性质在反应前后又保持不变,才能作为过氧化氢分解的催化剂;
b、要想证明Fe2O3的化学性质在反应后是否改变,实验方案如下:取操作B的滤渣于试管中加入过氧化氢溶液;产生大量气泡。

【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | 氯酸钾 | 580℃ |
② | 氯酸钾、二氧化锰(质量比 1:1) | 350℃ |
③ | 氯酸钾、氧化铜(质量比 l:1) | 370℃ |
④ | 氯酸钾、氧化铁(质量比 1:1) | 390℃ |
(分析数据、得出结论)
(1)由实验_____对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是_____。
(3)若氧化铁是该反应的催化剂,请写出这个反应的文字表达式_____。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
①据如表可知二氧化锰与氯酸钾的质量比为_____时,反应速率最快;
②通过分析可知,在化学反应中催化剂的用量_____越多越好。(填“是”或“不是”)
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的_____,所以反应速率受到影响。