题目内容
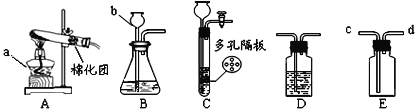
【题目】有下图装置,请回答有关问题:
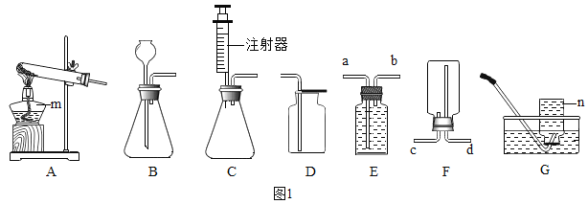
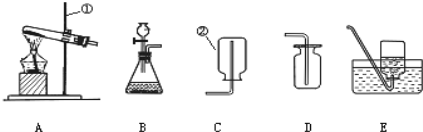
(1)图中标有字母的仪器的名称:m____,n_____。
(2)实验室用氯酸钾和二氧化锰共热制取氧气,应选用的发生装置是____(填字母序号),反应的化学方程式为____。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,与B相比优点是____。
(4)若用装置E收集氧气,则气体从____(填“a”或“b”)端通入;若使用装置F收集氧气,则气体应从_____(填“c”或“d”)端通入。
(5)小明对妈妈杀鱼时从鱼肚内取出的鱼鳔(如图所示)产生了兴趣,他以“探究鱼鳔内气体体积和成分”作为研究性学习的课题进行探究实验,通过查阅资料获知:这种鱼鳔内氧气约占1/4,其余主要为二氧化碳和氮气,且二氧化碳能溶于水。以下是小明分两步进行的探究实验:
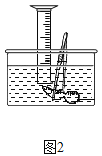
①用两种方法测量鱼鳔内气体体积:A、用医用注射器抽取鱼鳔内气体,测量其体积;B、在水下刺破鱼鳔,用排水集气法收集鱼鳔内气体并测量其体积(如图所示)。你认为测量结果最不准确的一种方法是_____(填“A”或“B”),理由是___。
②探究鱼鳔内气体的成分:用两瓶鱼鳔内的气体进行实验,帮助他完成下表中的实验记录:
实验目的 | 实验方法 | 实验现象 |
验证鱼鳔内含O2 | _____ | ______ |
验证鱼鳔内含CO2 | _____ | ______ |
【答案】酒精灯 集气瓶 A 2KClO3![]() 2KCl+3O2 ↑ 能控制反应的速率 b c B 二氧化碳溶于水 在盛有鳔内气体的集气瓶中插入燃着的木条 木条继续燃烧 在盛有鳔内气体的另一集气瓶中加入澄清的石灰水 石灰水出现浑浊
2KCl+3O2 ↑ 能控制反应的速率 b c B 二氧化碳溶于水 在盛有鳔内气体的集气瓶中插入燃着的木条 木条继续燃烧 在盛有鳔内气体的另一集气瓶中加入澄清的石灰水 石灰水出现浑浊
【解析】
(1)根据常见仪器可知:m是酒精灯;n是集气瓶;
(2)实验室用氯酸钾和二氧化锰共热制取氧气,属于固固加热型,选择发生装置A,氯酸钾在二氧化锰和加热条件下生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl+3O2 ↑;
2KCl+3O2 ↑;
(3)用图C所示装置可以代替图B装置,与B相比,图C所示装置能通过注射器控制滴加液体的速率,能控制反应的速率;
(4)若用装置E收集氧气,瓶中装满水,是用排水法收集气体,长导管是出水管,则气体从b端通入;若使用装置F收集氧气,是用向上排空气法收集气体,则气体应从c端通入,将密度小的空气从长导管排出;
(5)①二氧化碳溶于水,不能用排水法收集;
②氧气具有助燃的特性,燃着的木条放入瓶中木条可以继续燃烧,实验如下:在盛有鳔内气体的集气瓶中插入燃着的木条,木条继续燃烧,证明鳔内含O2;二氧化碳可以使澄清石灰水变浑浊,实验如下:在盛有鳔内气体的另一集气瓶中加入澄清的石灰水,石灰水出现浑浊,证明鳔内含CO2。

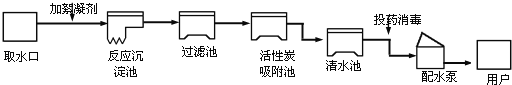
【题目】某化学兴趣小组回收废旧干电池填料中的二氧化锰和氯化铵.
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水.兴趣小组的同学们设计回收物质的流程如下图所示.
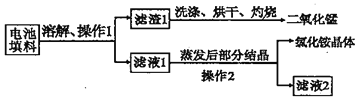
(1)操作 1 的名称是______,该操作中玻璃棒的作用是______.
(2)灼烧滤渣 l 的目的是________.
(3)二氧化锰是氯酸钾受热分解的催化剂,下表是他们的有关实验数据,请你回答有关问题:
二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
据上表可知二氧化锰与氯酸钾的质量比为____时,反应速率最快.分析可知反应前后二氧化锰在固体混合物中质量分数是____(选填“不变”或“变大”或“变小”).
【题目】某某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1______t2(填“>”“=”“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是__________。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
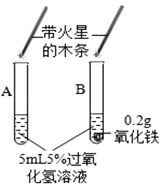
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
小组的同学认为要证明Fe2O3是催化剂,上述二个实验还不够,还需要再增加一个实验,
a、该实验的目的是:____________
b、请你设计实验证明,简要的写出实验步骤及实验现象:_________。
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。
【题目】如图是化肥碳酸氢铵包装袋上的部分说明,可推测碳酸氢铵具有的性质有_______(填字母)。
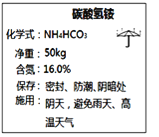
A.易溶于水 B.受热易分解
某同学提出疑问“这种化肥含氮量是否达到16%,化肥中碳酸氢铵的质量分数是多少?”
带着这些问题,该同学进入实验室完成了下列实验。
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3
②浓硫酸能吸收NH3但是不吸收CO2
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:
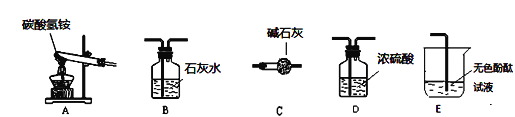
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是_____。
②取适量碳酸氢铵加入试管,连接A、B装置,加热,观察到B中的现象是________。
③再取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是__________。
④碳酸氢铵在受热时发生反应的化学表达式是_______。
(含量分析)将装置A、C、D依次连接,加入10g化肥样品,加热至A中固体完全消失。称量装置D的质量如表 (各装置对气体吸收是完全的) :
实验前D装置的质量 | 150.0g |
实验后D装置的质量 | 151.7g |
⑤由此分析得知:反应中产生氨气的质量为__________g。
⑥通过反应的化学表达式可知:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥中氮元素的质量分数为__________(结果保留到0.1%)。
⑦此化肥中碳酸氢铵的质量分数为__________(结果保留到0.1%)。