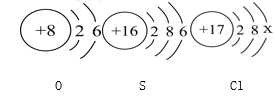题目内容
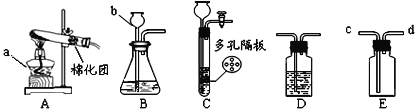
【题目】某化学小组同学用如图所示实验验证质量守恒定律。
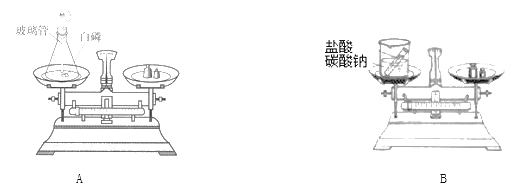
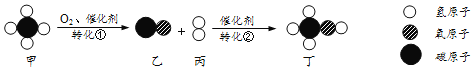
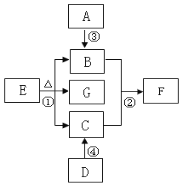
(1)B图中碳酸钠和盐酸反应的化学方程式是:Na2CO3+2HCl = 2NaCl+CO2↑+X,其中X的化学式是________。
(2)小组同学经实验观察到A实验反应前后质量不变,B实验反应后质量减少了,于是有同学认为并不是所有的反应都符合质量守恒定律,你认为他们的观点是否正确____。B实验质量减少的原因是______。
(3)在B实验中,实验前天平示数为102.2克,实验后天平示数为100克,则生成二氧化碳质量为_______克。
(4)根据以上实验分析和总结:在做验证质量守恒定律实验时需要注意的问题是有气体参加或有气体生成的反应,应在______中进行。
(5)由以上实验可知,化学反应前后一定不变的有_______(填序号)。
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质总质量 A.①②③④ B.①②④⑤ C.①②⑤⑥ D.①②④⑥
【答案】H2O 不正确 反应中生成了二氧化碳气体逸散到了空气中(合理即可) 2.2 密闭容器 C
【解析】
(1)根据质量守恒定律,原子的种类和个数在反应前后不变,x中含两个氢原子和一个氧原子,所以x的化学式为H2O,故填H2O。
(2)所有的化学反应均遵循质量守恒定律,所以它们的观点不正确,故填不正确;
B实验的装置是开放的,反应生成的气体逸散到空气中,故填反应中生成了二氧化碳气体逸散到了空气中(合理即可)。
(3)生成二氧化碳的质量为102.2g-100g=2.2g,故填2.2。
(4)在做验证质量守恒定律实验时需要注意的问题是有气体参加或有气体生成的反应,为保证系统内质量不变,反应应该在密闭容器中发生,故填密闭容器。
(5)①原子在化学反应中不再分,所以原子种类不变;②原子在化学反应中不再分,所以原子数目也不变;③在化学反应中,分子分词原子,所以分子种类发生改变;④在化学反应中,分子数目不一定发生改变;⑤在化学反应中,原子种类不变,所以元素种类也不改变; ⑥物质总质量在化学反应前后不变,所以化学反应前后一定不变的有①②⑤⑥,故选C。

【题目】某某学习小组的同学对过氧化氢分解进行探究。
Ⅰ.(探究一)影响过氧化氢分解快慢的因素
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的溶质质量分数% | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1______t2(填“>”“=”“<”)
(2)能说明过氧化氢分解快慢与溶质质量分数有关的实验是_____(填实验序号),合理的结论是__________。
(交流探讨)MnO2属于金属氧化物,其它金属氧化物能否起到类似MnO2的催化作用?
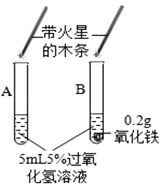
Ⅱ、(探究二)探究Fe2O3是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | Fe2O3_____(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、_____。 | 固体质量0.2g | Fe2O3质量未变 |
小组的同学认为要证明Fe2O3是催化剂,上述二个实验还不够,还需要再增加一个实验,
a、该实验的目的是:____________
b、请你设计实验证明,简要的写出实验步骤及实验现象:_________。
(得出结论)过氧化氢分解快慢受温度、浓度、催化剂等因素影响。