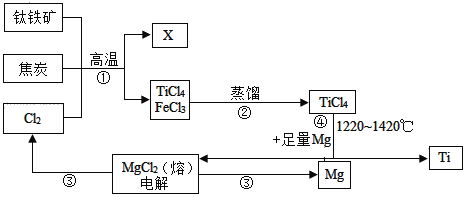
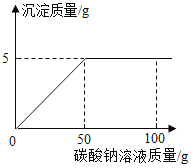
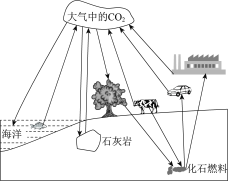
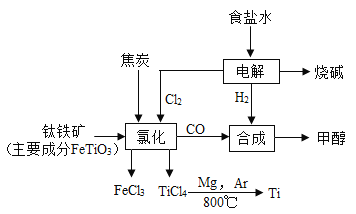
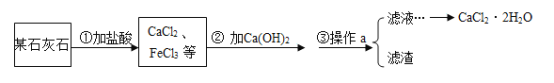
题目内容
【题目】甲酸(化学式为 HCOOH)在隔绝空气加热时会分解生成两种氧化物。某小组共同探究了甲酸的部分化学性质和分解产物(下图是该小组将甲酸分解产生的气体通过的实验装置)。
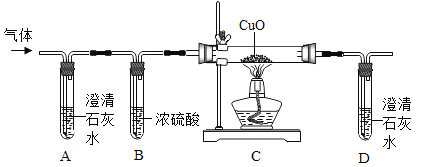
关于该实验有下列说法:
①向盛有甲酸溶液的试管中滴加紫色石蕊溶液,观察到溶液变成红色,说明甲酸溶液显碱性
②根据质量守恒定律,推测出甲酸分解时生成了水,另一种氧化物是 CO 或 CO2
③另一种氧化物若是 CO,则装置 C 要得到 3.2 克铜,最多需要 2.3 克甲酸。
④另一种氧化物若是 CO,则装置 C 中的现象为黑色固体里有红色物质出现
⑤从环保角度看,上述装置存在明显的缺陷;其中不正确的有( )
A.①B.③⑤C.①③D.②④⑤
【答案】C
【解析】
①向盛有甲酸溶液的试管中滴加紫色石蕊溶液,观察到溶液变成红色,说明甲酸溶液显酸性,故①错误
②甲酸(HCOOH)化学式可知,甲酸是由氢、氧、碳三种元素组成,根据质量守恒定律,推测出甲酸分解时生成了水,另一种氧化物是 CO 或 CO2,故②正确;
③设:装置C要得到 3.2 克铜,最少需要甲酸质量为x。
另一种氧化物若是 CO,则甲酸加热分解生成水和一氧化碳,反应的化学方程式为:HCOOH![]() H2O+CO↑,一氧化碳与氧化铜加热时生成铜和二氧化碳,反应的化学方程式为:CO+ CuO
H2O+CO↑,一氧化碳与氧化铜加热时生成铜和二氧化碳,反应的化学方程式为:CO+ CuO![]() Cu + CO2;根据上述两个化学方程式则有:
Cu + CO2;根据上述两个化学方程式则有:
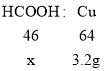
![]() x=2.3g。由于反应开始时,为防止爆炸,先在要通入CO,则装置 C 要得到 3.2 克铜,最少需要 2.3 克甲酸。故③错误;
x=2.3g。由于反应开始时,为防止爆炸,先在要通入CO,则装置 C 要得到 3.2 克铜,最少需要 2.3 克甲酸。故③错误;
④一氧化碳与氧化铜加热时生成铜和二氧化碳,另一种氧化物若是 CO,CO与氧化铜加热时生成铜和二氧化碳,则装置 C 中的现象为黑色固体里有红色物质出现,故④正确;
⑤一氧化碳有毒,不能直接排放到空气中。从环保角度看,上述装置存在明显的缺陷,没有尾气处理装置,故⑤正确。其中不正确的有①③。故选C。

 名校课堂系列答案
名校课堂系列答案【题目】取10g锌粉和铜粉的混合物于烧杯中,向烧杯中分四次加入等质量的同种稀硫酸,实验过程中得到如下数据。
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸的质量 | 20g | 20g | 20g | 20g |
剩余固体的质量 | 8.7g | 7.4g | 6.1g | 5.5g |
(1)混合物中铜粉的质量是________。
(2)所用稀硫酸中溶质的质量分数是_____。(保留计算过程)
【题目】某校化学活动小组准备探究气体的测定和数据处理方法。
(提出问题)如何利用石灰石与稀盐酸反应来测定生成CO2的质量和体积,并处理数据.
(实验设计)通过下列两个实验分别测定CO2的质量和体积:
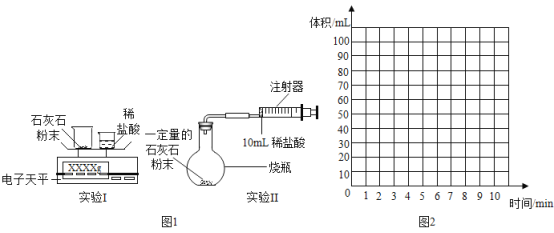
(分析与表达)
(1)上述两个实验中,反应的化学方程式为________。
(2)实验Ⅰ中,将小烧杯中的所有稀盐酸分几次加入到大烧杯中,并不断搅拌,判断石灰石中CaCO3完全反应的实验现象是________。
(3)实验Ⅱ中,先连接好装置,在检查装置的气密性(请简述方法________),然后装好药品,最后将10mL稀盐酸快速推入烧杯中,若稀盐酸是缓慢推入的,则可能造成的后果是________.
(4)(记录与处理)
已知实验Ⅰ反应前的总质量(m(大烧杯+石灰石粉末)+m(小烧杯+稀盐酸)),要计算生成CO2的质量,至少还需要的数据是___________。
A m(小烧杯) B m(大烧杯) C m(大烧杯+反应后剩余物)
(5)实验Ⅱ的实验记录如下(表中数据在相同温度、相同压强条件下测定)
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/ml | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
据以上实验过程和实验数据综合分析,最终生成CO2的体积是________ mL
注意:若答对下面题奖励4分,但化学总分不超过60分。
(6)根据你的认识,在图2中坐标图中绘制出0~10min生成CO2体积随时间变化的曲线。________
(7)(反思与评价)
经过分析,你认为实验Ⅰ的优点是________,实验Ⅱ的优点是________。