题目内容
【题目】硫酸钡是一种不溶于水,也不和酸反应的固体,医疗上常用硫酸钡作透视肠胃的内 服造影剂,俗称“钡餐”。若“钡餐”中含有碳酸钡,就会致人中毒。为测定某硫酸钡样品中碳酸钡的 含量,取 100 g 样品,向其中逐渐加入一定质量分数的稀硝酸至恰好完全反应,发生反应的化学方 程式为:BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑,测得共用去稀硝酸 245.7 g,反应后称得烧杯中物质的总质量为 341.3 g。请计算:
(1)反应生成的二氧化碳为_____g。
(2)所用的稀硝酸的溶质质量分数是多少_________?原样品中硫酸钡的质量分数是多少?(计算结果保留一位小数)__________
【答案】4.4 5.1% 80.3%
【解析】
(1)反应生成的二氧化碳为:100g+245.7g-341.3g=4.4g;故填:4.4;
(2)设生成4.4 g二氧化碳需要碳酸钡的质量为x,同时消耗硝酸的质量为y

x=19.7g y=12.6g
稀硝酸的溶质质量分数为:![]() ×100%
×100%![]() 5.1%
5.1%
样品中硫酸钡的质量分数为![]() ×100%=80.3%
×100%=80.3%
答:所用稀硝酸的溶质质量分数为5.1%,样品中硫酸钡的质量分数为80.3%。

 阅读快车系列答案
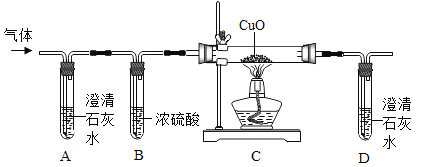
阅读快车系列答案【题目】某兴趣小组同学利用图1装置制取气体并探究气体的某些性质.
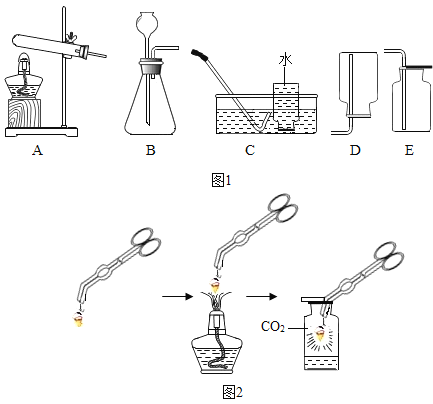
(1)制取气体
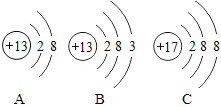
①若选择A与C组合制取氧气,反应的化学方程式为__.
②用石灰石和稀盐酸制取CO2的化学方程式为__,选用的发生与收集装置是__(填标号).连接好装置,将药品加入装置前应进行的操作是__.
(2)探究气体的性质
某同学在空气中点燃镁条,想利用CO2来熄灭燃烧的镁条,结果发现镁条在充满CO2的集气瓶中没有熄灭反而剧烈燃烧,集气瓶内壁出现黑色固体,瓶底出现白色固体,实验过程如图2所示.请回答:
①夹持镁条的仪器名称是__;
②生成的黑色固体是__(写化学式);
③查阅资料:MgO、Mg(OH)2、MgCO3均为难溶于水的白色固体.同学讨论后认为白色固体不可能是Mg(OH)2,理由是__.
④为进一步确定白色固体的成分,进行如下实验:
实验操作 | 实验现象 | 实验结论 |
取白色固体于试管中,加入足量稀盐酸 | __ | 白色固体不是MgCO3,而是MgO |
⑤镁在CO2中燃烧的化学方程式为__;通过上述探究,你对燃烧或灭火的新认识是__.