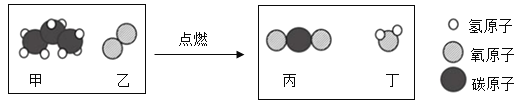
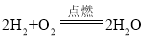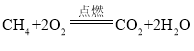题目内容
【题目】在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得 到 75g 混合 溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠 溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示。计 算:
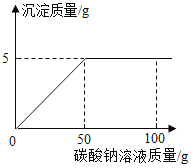
(1) 恰好完全反应 时生成沉淀 质量为 g。
(2) 若恰好完全反应时所得溶 液的溶质质量分数为 10%,则原固体混合物的质量是多少
【答案】(1)5g;(2)11.7g
【解析】
(1)由图象可知,生成CaCO3的质量为5g,
(2)设参加反应的CaCl2质量为x,生成NaCl的质量为y,
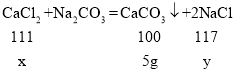
![]() x=5.55g,
x=5.55g,
![]() y=5.85g,
y=5.85g,
所得溶液中NaCl的质量(75g+50g-5g)×10%=12g,
原固体混合物的质量 12g-5.85g+5.55g=11.7g。

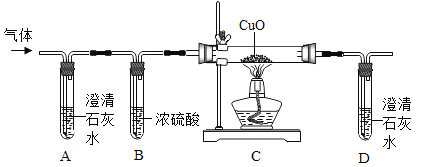
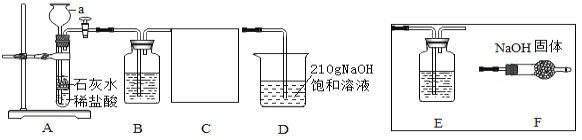
【题目】在20℃环境中,制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验。
(查阅资料)(1)碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
(2)20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
(定性探究)(1)仪器a的名称是____________________;
(2)装置B中盛有 NaHCO3溶液,目的是吸收装置A中挥发出的HCl气体,写出B中发生反应的化学方程式:_______________;
(3)装置C的作用是______________,选择________(选填E、F)达到实验目的;
(4)在实验过程中装置D中观察到______________,说明CO2和NaOH溶液能发生反应。
(定量计算)
(5)装置D中NaOH全部转化成Na2CO3时,理论上最多可以生成Na2CO3多少克____________?
(6)当向装置D中通入足量的CO2时,可以将NaOH全部转化为NaHCO3,实验过程中会析出的NaHCO3质量___________g(不考虑结晶水)。