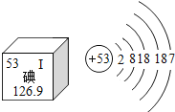
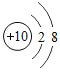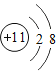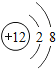题目内容
【题目】下列各组离子在pH=14的溶液中都能大量共存,且溶液呈无色的是( )
A.Cu2+、Mg2+、![]() 、
、![]()
B.Fe3+、Ca2+、![]() 、Cl-
、Cl-
C.Ca2+、K+、![]() 、Cl-
、Cl-
D.Na+、K+、![]() 、
、![]()
【答案】D
【解析】
pH=14的溶液有大量的OH-,然后利用离子之间不能结合生成水、气体、沉淀来分析解答,且要注意溶液成无色,不能存在有色离子。
A、Cu2+为有色离子,且Cu2+、Mg2+都能和OH-生成沉淀,故不能大量共存,A项错误;B、Fe3+为有色离子,且Fe3+、Ca2+都能和OH-生成沉淀,不能大量共存,B项错误;C、Ca2+能和OH-生成沉淀,不能大量共存,C项错误;D、Na+、K+、![]() 、
、![]() 都不和OH-发生反应,能大量共存,D项正确。故选D。
都不和OH-发生反应,能大量共存,D项正确。故选D。

 名校课堂系列答案
名校课堂系列答案【题目】学习了氧气的知识,兴趣小组同学对氧气在生活中的应用进行了探究。

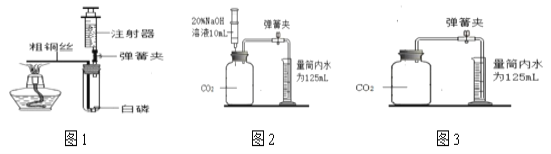
(查阅资料)家用制氧机(如图1)的工作原理如下:加压时,装填制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气:减压时,分子筛将所吸附的氮气排放,整个过程中,分子筛并不消耗。兴趣小组同学用家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验一:小组同学准备通过以下实验验证所收集的气体是否为纯净的氧气。
(实验记录)取一只250mL的集气瓶,用排水法收集一瓶所带气体,然后把一根燃着的木条插入集气瓶中,木条燃烧得更旺。
(实验结论)收集的气体是纯净的氧气。
(实验反思)老师指出上述实验并不能证明小组同学所带来的气体一定是纯净的氧气。该实验不能确定所收集气体为纯净氧气的原因是___________。
实验二:测定小组同学所带气体中氧气的含量。
同学们在老师的指导下设计了如图2所示装置,进行实验,并重复多次。请补充完实验记录。
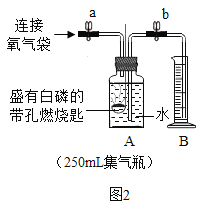
(实验步骤)
①检查____________。
②加入药品,将装置连接固定。
③打开止水夹a和b,向A中缓慢鼓入一定量气体,露出白磷后,关闭止水夹a和b, A中水进入到B中,测得B中水的体积为V1mL。
④用凸透镜聚光引燃白磷,白磷燃烧,产生大量白烟。
⑤待白磷熄灭并冷却到室温,进行_______操作。B中水倒吸进入A中,测得量筒中的体积变为V2mL 。
⑥计算小组同学所带气体中氧气的体积分数。
(1)请填(“不变”或“偏高”或“偏低”)
A 步骤③中,仰视量筒读数会使测得的V1数值____________;
B 步骤⑤中,未冷却至室温会使测得的小组同学所带气体中氧气的含量__________;
(2)(数据记录)
经测定V1=110mL; V2数据如下:
实验次序 | 1 | 2 | 3 | 4 | 5 |
B 中剩余水体积/mL | 27 | 26 | 50 | 24 | 23 |
(数据处理)
已知,在如表数据中,其中有一次数据偏差较大,存在明显误差,在数据处理时应删去。小组同学所带气体中氧气的体积分数为___________(保留小数点后一位有效数字)。
(实验反思)
①家用制氧机制氧气的过程发生的变化属于__________(填“物理变化”或“化学变化”)。
②用高锰酸钾制取氧气,由于制取成本较高,不适合大量生产,一般用于实验室制取。
③导致那次数据产生较大误差的可能原因是__________。
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是_____;
(2)表中所列3种催化剂的催化效果最佳的是_____;
(3)写出实验3中KClO3分解的化学方程式:_____;
(4)由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____;
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____;
(6)用图装置测量一定量的氯酸钾和二氧化锰加热分解后产生O2的体积,实验时应_____(选填“气泡连续均匀”或“刚有气泡”)时开始收集气体。

①以下是用该装置测量收集到的气体的体积必须包括的几个步骤:
A调整量筒内外液面使之相平
B使试管和量筒内的气体都冷却至室温
C读取量筒内气体的体积
这三步操作的正确顺序是:_____(请填写步骤代号)。
②若实验结束时,量筒内的液面高于水槽中的液面,要使量筒内外液面的高度相同可采用的操作是_____(填操作方法)。
③某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为_____。
A 10.5% B 14.5% C 25.5% D 50%