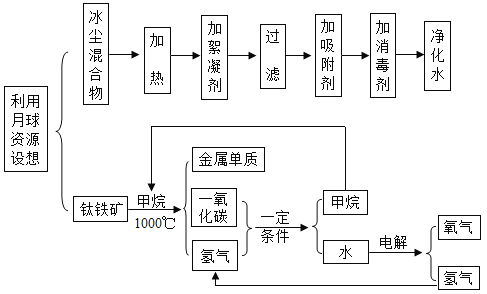
题目内容
【题目】小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图:
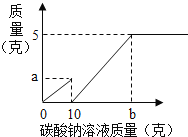
(1)图象中的a点数值
(2)废液中含有的溶质是 (写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是多少?
【答案】(1)1.1;(2)HCl、CaCl2;
(3)图象横坐标中b点表示的溶液的质量是30g.
【解析】
试题分析:石灰石和稀盐酸制取二氧化碳产生的废液中一定含有生成的氯化钙,可能含有盐酸;取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,说明废液中含有盐酸;滴加至10克开始出现白色沉淀,说明废液中含有氯化钙;故废液是盐酸和氯化钙溶液的混合物.
图象中的a点数值是产生的二氧化碳的质量,可以根据碳酸钠溶液的质量、溶质的质量分数求出;图象横坐标中的b点表示的碳酸钠溶液的质量,可以根据产生沉淀的质量为5g,由反应的化学方程式计算求出.
解:(1)图象中的a点数值是二氧化碳的质量,设生成的二氧化碳的质量为x
Na2C03+2HCl=2NaCl+H2O+CO2↑
106 44
10g×26.5% x
![]() x=1.1g.
x=1.1g.
(2)取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,说明废液中含有盐酸;滴加至10克开始出现白色沉淀,说明废液中含有氯化钙;故废液是盐酸和氯化钙溶液的混合物,废液中含有的溶质是HCl、CaCl2.
(3)设与氯化钙反应的碳酸钠溶液中溶质质量为y,
CaCl2+Na2C03=2NaCl+CaC03↓
106 100
y 5g
![]() y=5.3g
y=5.3g
所需碳酸钠溶液质量是5.3g÷26.5%=20g
b点表示的溶液的质量为20g+10g=30g.

【题目】研究“水”可从多角度展开。
(1)生活中的水。
(资料在线)我国生活饮用水的标准(摘录部分)。
项目 | 内容 |
感官指标 | 水质无色无味且澄清透明 |
化学指标 | pH6.5~8.5;总硬度<250mg/L(以碳酸钙计);铜<1.0mg/L,铝<0.2mg/L…… |
细菌学指标 | 细菌总数<100个/mL等 |
①自来水厂过滤前常加入明矾沉降悬浮性杂质,再用_____来吸附色素和异味,从而达到感官指标。
②生活中鉴定硬水、软水的方法是,取少量饮用水中加入_____,振荡,出现大量浮渣现象的为_____。生活中若要对硬水进行软化,可采取的办法是_____。
(2)探究水的组成
某校化学兴趣小组想亲自感受科学家的探究历程,他们选择了“水的组成粗略测定”为探究内容。
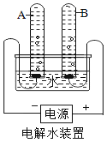
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_____,用带火星的木条检验B中气体,现象是_____。
②微观该反应中发生分解的微粒名称是_____。
③结论:水由_____组成。发生的化学反应方程式为_____。
④下列关于电解水的说法中正确的是_____(填序号)。
A氢、氧两种元素的化合价均发生了改变
B氢原子和氧原子没有发生变化
C水分子是化学变化中最小的微粒
D该反应为分解反应
(3)探究水的性质
将二氧化碳通入紫色石蕊试液中,溶液变红,写出该反应的化学方程式_____。
(4)水的用途:
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是_____。
②作溶剂:如溶解氯化钠、蔗糖等许多物质。