题目内容
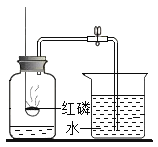
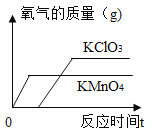
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是_____;
(2)表中所列3种催化剂的催化效果最佳的是_____;
(3)写出实验3中KClO3分解的化学方程式:_____;
(4)由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____;
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____;
(6)用图装置测量一定量的氯酸钾和二氧化锰加热分解后产生O2的体积,实验时应_____(选填“气泡连续均匀”或“刚有气泡”)时开始收集气体。

①以下是用该装置测量收集到的气体的体积必须包括的几个步骤:
A调整量筒内外液面使之相平
B使试管和量筒内的气体都冷却至室温
C读取量筒内气体的体积
这三步操作的正确顺序是:_____(请填写步骤代号)。
②若实验结束时,量筒内的液面高于水槽中的液面,要使量筒内外液面的高度相同可采用的操作是_____(填操作方法)。
③某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为_____。
A 10.5% B 14.5% C 25.5% D 50%
【答案】对比实验 MnO2 2KClO3![]() 2KCl+3O2↑ 有 生成的KCl加快了反应 收集气体的体积 气泡连续均匀 BAC 慢慢将量筒下移 B
2KCl+3O2↑ 有 生成的KCl加快了反应 收集气体的体积 气泡连续均匀 BAC 慢慢将量筒下移 B
【解析】
(1)通过对比才能知道实验2、3、4中加入药品后有无催化作用;
(2)除了加入药品不同外,其他条件都相同,根据对比可知,收集相同体积的氧气,实验2所用时间最短,即二氧化锰的催化效果最好;
(3)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(4)由实验1和实验4可知,KCl有催化作用;维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,是因为氯酸钾分解生成的氯化钾对反应起了催化作用;
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内收集氧气的体积。
(6)用图装置测量一定量的氯酸钾和二氧化锰加热分解后产生O2的体积,实验时应气泡连续均匀时开始收集气体。
①读取量筒内气体的体积,肯定是最后一步,使试管和量筒内的气体都冷却至室温,否则装置中的气体处于受热膨胀状态,体积会偏大,接下来为了能够读取量筒内气体的体积,要调整量筒内外液面高度使之相同,所以这三步操作的正确顺序是:B.使试管和量筒内的气体都冷却至室温;A.调整量筒内外液面使之相平;C.读取量筒内气体的体积;
②试管和量筒内的气体都冷却后,量筒内的液面一定高于量筒外的液面,慢慢将量筒下移,量筒上方气体体积减小,压强增大,当量筒内气体压强等于外界大气压时,量筒内液面和水槽内液面相平;
③由题意可知,剩余物的成分是KClO3、KCl、MnO2,其中钾元素的质量分数39.0%,由化学式可知,钾元素和氯元素的质量比是39:35.5,则混合物中氯元素的质量分数是35.5%,所以氧元素的质量分数是:1-11.0%-39.0%-35.5%=14.5%.所以选择项B符合题意。
故答案为:
(1)对比实验;
(2)MnO2;
(3)2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(4)有;生成的KCl加快了反应;
(5)收集气体的体积;
(6)气泡连续均匀;BAC;慢慢将量筒下移;B。

 阅读快车系列答案
阅读快车系列答案【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ氧化铜是反应的催化剂,反应前后_______________和_____________不变。
(实验)用天平称量![]() 氧化铜,取
氧化铜,取![]() 的过氧化氢溶液于试管中,进行如下实验:
的过氧化氢溶液于试管中,进行如下实验:
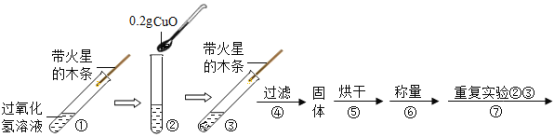
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
①_____________ ②带火星的木条复燃 | 所得固体_________g | 溶液中有气泡放出 ②带火星的木条______(填“复燃”或“不复燃”) | 猜想Ⅰ、Ⅱ不成立猜想Ⅲ成立 |
(2)步骤①的目的是___________________。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为:___________________。
(4)过氧化氢反应生成氧气的快慢除了与是否使用催化剂有关,与催化剂的种类有关外,还与什么因素有关呢?请写出你的猜想并设计实验方案验证你的猜想。
①你的猜想是过氧化氢反应生成氧气的快慢与_________________有关;
②你的实验方案是:____________________。
【题目】石灰石是主要矿产品之一,某学校研究性学习小组为了测量当地矿石山石灰石中CaCO3的质量分数,取一些矿石样品,并取稀盐酸200g,平均分成4份,分4次进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 |
加样品的质量(g) | 5 | 10 | 15 | 20 |
生成CO2的质量(g) | 1.76 | 3.52 | 4.4 | m |
问:(1)哪几次实验中矿石有剩余?_____。
(2)表中m的数值是_____。
(3)试计算这种石灰石中CaCO3的质量分数_____。
(4)试计算这种稀盐酸溶质的质量分数_____。