��Ŀ����
����Ŀ��̼��������С�մ����Ҫ�ɷ֣�����������������������Ҫ����;��
��������̽��
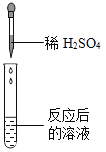
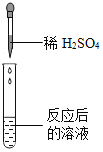
��ѧ���ϣ�ͬѧ��Ϊ�˽�̼�����Ƶ����ʣ���һ��������̼�����ƺ�ϡ�����ϣ���ַ�Ӧ���������ݳ���д���÷�Ӧ�Ļ�ѧ����ʽ_________________________��ͬѧ�ǶԷ�Ӧ����Һ�����ʵijɷֽ�����̽������Ϊ��һ����������������ܻ����������ɷ֣���˽����˲��벢��������ʵ�飺
��ʵ����Ʒ��pH��ֽ��пƬ������ͭ��ĩ��ϡ���ᡢ����������Һ���Ȼ�����Һ��
����������裩��Ӧ����Һ�����ʵĿ�����ɳɷ�
����һ�������� ������������ơ�̼������ �������������ơ�����
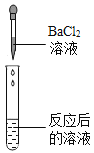
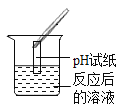
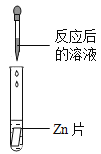
��ʵ��̽����ͬѧ��ȡ��Ӧ�����Һ�ò�ͬ������������ʵ�飬����ݽ�������±�ʵ�������еĢ٢ڢۡ�
ʵ�鷽�� | A | B | C | D | |
ʵ����� |
|
|
|
| |
ʵ������ | ________ | ������ɫ���� | ��ֽ��ɫ�����ձ���ɫ����pH________7 | _________ | |
ʵ����� | ���������ȷ | ��������ȷ | ��������ȷ | ��������ȷ |
���ó����ۣ���������ȷ��
�����۷�˼��
��1����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ��ʵ����۸����˿϶���ͬʱָ��̽���д���һ�����Բ��������ǣ�_____��
��2����ͬѧ��ʵ�鷽��B�Ľ�����������ɣ���Ϊ��ƾ�������ܵó���������ȷ����˵������________��
���ܽ���ߣ���������ʵ����Ʒ����Ʋ�ͬ�ķ���ȷ�ϲ���������ȷ�ġ���д�����ʵ�鷽��________��
��������̽��
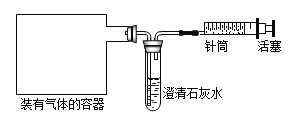
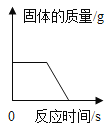
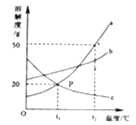
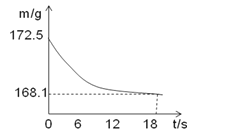
��1��ȡһ������̼��������Ʒ�����뵽ʢ������ϡ������ձ��У��ձ�����Ϊ118.1�ˣ��������ò��������衣��Ӧ�����þ�����������ձ��ͻ�������������m���뷴Ӧʱ�䣨t����ϵ��ͼ��ʾ����������Һ��������������________��
���𰸡�2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2�� ���������� С�� пƬ�ܽ⣬�������� ��pH��ֽ������Һ�� ������Ҳ�ܺ��Ȼ�����Ӧ���ɰ�ɫ���� ʵ�鲽�裺����������ͭ�����Թ��У�����������Ӧ�����Һ��ʵ����������ͭ�ܽ⣬��Һ����ɫ����ɫ��ʵ����ۣ���Һ�к������ᣨ�����������ɣ� 14.2%
��������
��������̽��
̼�����ƺ�ϡ���ᷴӦ���������ơ�ˮ�Ͷ�����̼���÷�Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2����
���2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2����
[ʵ��̽��]
ʵ�����������ʾ��
ʵ�鷽�� | A | B | C | D |
ʵ����� |
|
|
|
|
ʵ������ | ���������� | ������ɫ���� | ��ֽ��ɫ�����ձ���ɫ����pHС��7 | пƬ�ܽ⣬�������� |
ʵ����� | ���������ȷ | ��������ȷ | ��������ȷ | ��������ȷ |
[���۷�˼]
��1��̽���д���һ�����Բ��������ǰ�pH��ֽ������Һ�С�
�����pH��ֽ������Һ�С�
��2����ƾ�������ܵó���������ȷ�����ɣ�������Ҳ�ܺ��Ȼ�����Ӧ���ɰ�ɫ������
���������Ҳ�ܺ��Ȼ�����Ӧ���ɰ�ɫ������
[�ܽ����]
ʵ�鷽����ʵ�鲽�裺����������ͭ�����Թ��У�����������Ӧ�����Һ��
ʵ����������ͭ�ܽ⣬��Һ����ɫ����ɫ��
ʵ����ۣ���Һ�к������ᡣ
���ʵ�鲽�裺����������ͭ�����Թ��У�����������Ӧ�����Һ��
ʵ����������ͭ�ܽ⣬��Һ����ɫ����ɫ��
ʵ����ۣ���Һ�к������ᡣ
��������̽��
��1���跴Ӧ��������������Ϊx��
��Ӧ���ɶ�����̼����Ϊ��172.5g-168.1g=4.4g��
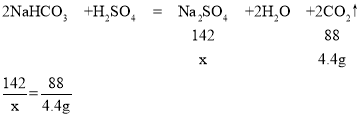
x=7.1g��
������Һ��������������Ϊ��![]() ��100%=14.2%��
��100%=14.2%��
��������Һ��������������Ϊ14.2%��