题目内容
根据下图所示的实验过程和提供的数据,下列判断不正确的是
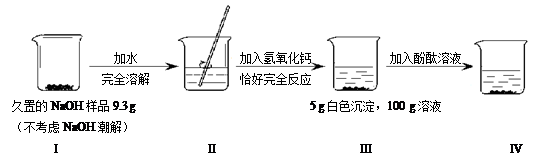

| A.I中未变质的NaOH质量为5.3 g | B.II中溶液有两种溶质 |
| C.III中溶液溶质的质量分数为8% | D.IV中溶液为红色 |
A
试题分析:久置的氢氧化钠会与空气中的二氧化碳反应生成碳酸钠,而碳酸钠能与加入的氢氧化钙溶液反应,会生成碳酸钙沉淀,结合题意可知,III中的5g白色沉淀即为生成的碳酸钙。根据题意,书写反应的化学方程式,利用碳酸钙的质量,即可计算出样品中碳酸钠的质量,进而计算出氢氧化钠的质量。
设样品中碳酸钠的质量为x
Na2CO3+Ca(OH)2= CaCO3↓+ 2NaOH
106 100
x 5g
106:100= x:5g
解得,x=5.3g
则样品中氢氧化钠的质量为9.3g-5.3g=4g,故A错误;则II中溶液有碳酸钠和氢氧化钠两种溶质,B正确。
根据题意可知,III中所得溶液为氢氧化钠溶液,其中溶质来自两部分,其一是原样品中的氢氧化钠,其二是反应生成的氢氧化钠。
设反应生成的氢氧化钠的质量为y
Na2CO3+Ca(OH)2= CaCO3↓+ 2NaOH
100 80
5g y
100:80=5g:y
解得,y=4g
则III中溶液的溶质质量分数=
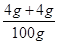 ×100%=8%,故C正确;
×100%=8%,故C正确;由于无色酚酞溶液遇碱液变红色,故D正确。故选A
点评:解答本题的关键是,根据题意找出反应生成的碳酸钙沉淀的质量,然后依据已知量对未知的应求量进行求解计算即可,要注意的是III中溶液中溶质来自两部分,其一是原样品中的氢氧化钠,其二是反应生成的氢氧化钠。

练习册系列答案
相关题目
 2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)