题目内容
化学小组同学取某黄铜(铜和锌的合金)样品进行如下实验,他们取该黄铜样品碎屑50g,把200g稀硫酸分4次加入到该样品中,测得数据记录如下表:

(1) 当加入稀硫酸的质量为 g时,反应恰好完成。
(2) 计算生成氢气的总质量(写出计算过程)。

(1) 当加入稀硫酸的质量为 g时,反应恰好完成。
(2) 计算生成氢气的总质量(写出计算过程)。
⑴ 125 (2) 0.5g
试题分析:(1)根据题意,铜和锌的合金加入稀硫酸后,由于锌是H前活泼金属,故与酸反应;而铜为H后不活泼金属,故不与稀酸反应;结合表格可知,固体中减小的量,即为参加反应的锌的质量。
从第一次与第二次的反应情况可以看出,每50g稀硫酸消耗锌的质量是50g-43.5g="43.5g" -37g=6.5g,所以第三次应剩余固体质量为37g-6.5g=30.5g,而实际质量大于此质量,故可知锌已完全反应,且锌的质量为50g-33.75g=16.25g,从而可计算出反应时硫酸的消耗量为16.25g ÷6.5g×50g=125g。
(2)利用锌的质量,依据化学方程式中锌与氢气的质量比,可求生成的氢气的质量。
解:设生成氢气的总质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 2
16.25g x
65:2=16.25g:x
解得x=0.5g
答:共生成氢气为0.5g。
点评:此题是关于化学方程式的计算题,要求学生要有较强的图表分析能力,解题的关键是,要能根据反应的事实,以及质量的变化,判断出参加反应的锌的质量;然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。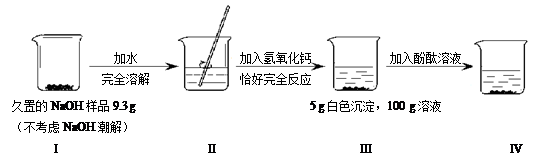



 C(金刚石)+2Na2O。请计算46 g金属钠理论上可制得金刚石的质量。
C(金刚石)+2Na2O。请计算46 g金属钠理论上可制得金刚石的质量。