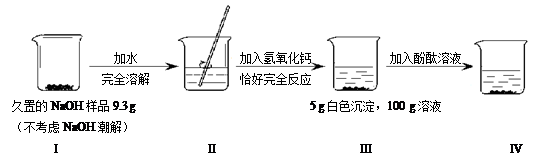
题目内容
某合金6g与足量的稀硫酸充分反应后,如果生成0.2g氢气,该合金中的元素可能是( )
| A.Zn和Fe | B.Cu和Au | C.Zn和Cu | D.Mg和Al |
A
试题分析:由题意可知:Cu和Au与硫酸都不反应;Zn与硫酸反应生成0.2g氢气时,至少需要6.5g Zn,Mg与硫酸反应反应生成0.2g氢气时,仅仅需要2.4g Mg,Al与硫酸反应反应生成0.2g氢气时,仅仅需要1.8g Al,Fe与硫酸反应反应生成0.2g氢气时,需要5.6g Fe,6g Zn和Fe的混合物与硫酸反应才可能生成0.2g氢气。选A。
点评:本题难度较大,其本质是根据化学方程式计算。解题技巧是先假设6g是纯金属,看看完全反应后生成多少氢气,再根据各组分金属与硫酸反应时生成氢气的质量关系来推断。

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 2CuSO4+
2CuSO4+