题目内容
在工业制取硫酸的过程中,有发生如下反应:4FeS2+11O2 2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
 2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)
2Fe2O3+8SO2.现有含FeS260%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2﹣120 SO2﹣64)64t
试题分析:设最多可生产SO2的质量为x,
4FeS2+11O2
 2Fe2O3+8SO2
2Fe2O3+8SO2480 512
100t×60% x
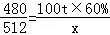 x=64t
x=64t 答:最多可生产SO2的质量为64t.
点评:本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目

 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。
 C(金刚石)+2Na2O。请计算46 g金属钠理论上可制得金刚石的质量。
C(金刚石)+2Na2O。请计算46 g金属钠理论上可制得金刚石的质量。