题目内容
【题目】某合金由铜与锌组成。现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,然后将200g溶质质量分数为19.6%的稀硫酸平均分四份依次加入该烧杯中,每次均充分反应。实验数据如下:
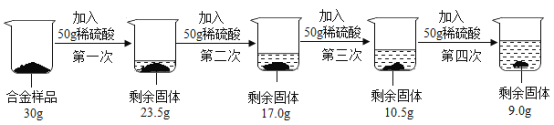
请计算:
(1)该合金中铜的质量为______________________g。
(2)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数__________________(写出简明计算过程,结果保留一位小数)。
【答案】9g 28.6%
【解析】
(1)在金属活动顺序中,锌排在氢之前,铜排在氢之后。铜不能与硫酸反应,根据实验数据可知,样品中铜的质量为9.0g。
(2)根据图示可知,第1次加50克稀硫酸,消耗锌的质量=30g-23.5g=6.5g,第2次加50克稀硫酸,消耗锌的质量=23.5g-17.0g=6.5g,第3次加50克稀硫酸,消耗锌的质量=17.0g-10.5g=6.5g,第三次加入稀硫酸充分反应后,参加反应的金属的质量=30.0g-10.5g=19.5g,参加反应的硫酸溶液的质量为50g×3=150g;
设:第三次所得溶液中ZnSO4的质量为x,生成H2的质量为y。
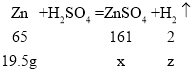
![]() x=48.3g;
x=48.3g;
![]() y=0.6g;
y=0.6g;
ZnSO4溶液中溶质质量分数=![]() 。
。
答:第三次加入硫酸充分反应后,所得溶液中溶质的质量分数约为28.6%。

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
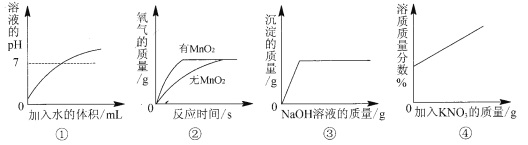
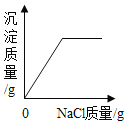
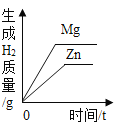
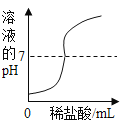
【题目】下列图像不能正确反映其对应操作的是
A | B | C | D |
|
|
|
|
在一定量的AgNO3溶液中逐滴加入NaCl溶液 | 等质量Zn和Mg分别与足量的等浓度稀硫酸反应 | 向NaOH溶液中逐滴加入稀盐酸 | 等质量CaCO3分别与足量的等浓度稀盐酸反应 |
A. A B. B C. C D. D