题目内容
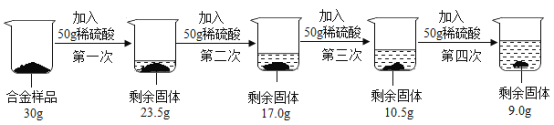
【题目】某校实验室有一包固体粉末可能由NH4Cl、Na2CO3、Ba(OH)2、BaCl2、Na2SO4中的一种或几种组成。为了确定其组成,某化学兴趣小组做了以下实验:
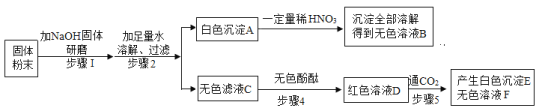
已知,步骤1中无明显现象;
请回答下列问题:
(1)这包固体中一定不存在的物质是_____;
(2)写出步骤2中产生白色沉淀A一定发生反应的化学方程式_____。
(3)步骤4所得红色溶液D中一定含有的溶质是_____。
(4)该实验小组实验结束后处理废液时,将无色溶液B、无色溶液F和沉淀E倒在了同一个废液缸里,发现沉淀消失并产生气泡,则废液缸中最终得到的废液中一定含有的溶质是_____。
【答案】NH4Cl、Na2SO4 Na2CO3+BaCl2=BaCO3↓+2NaCl、氢氧化钠、氯化钡 硝酸钡、氯化钠
【解析】
铵根离子和碱混合研磨会生成氨气,碳酸根离子和钡离子反应会生成溶于酸的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,氢氧化钠能使酚酞变红色,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钡反应生成碳酸钡沉淀,所以:固体粉末中加入熟石灰研磨,没有明显现象,所以固体粉末中一定不含氯化铵,得到的白色沉淀全部溶解,所以样品中一定不含硫酸钡,一定含有碳酸钠,无色溶液C中滴加酚酞变红色,溶液D中通入二氧化碳,会生成白色沉淀,所以C中一定含有氢氧化钠、氯化钡。
由分析可知(1)这包固体中一定不存在的物质是NH4Cl、Na2SO4;
(2)步骤2中产生白色沉淀A一定发生的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,化学方程式为 Na2CO3+BaCl2=BaCO3↓+2NaCl。
(3)步骤4所得红色溶液D中一定含有的溶质是:氢氧化钠、氯化钡;
(4)该实验小组实验结束后处理废液时,将无色溶液B、无色溶液F和沉淀E倒在了同一个废液缸里,发现沉淀消失并产生气泡,则废液缸中最终得到的废液中一定含有的溶质是硝酸钡、氯化钠。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案