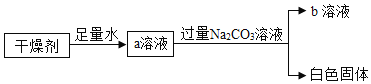
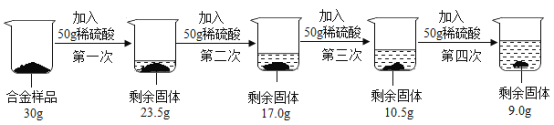
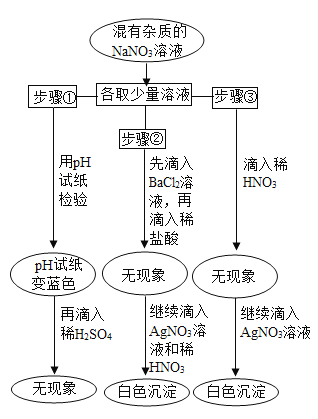
题目内容
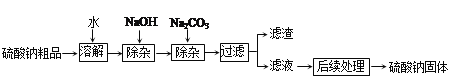
【题目】黑白复印机用的墨粉中常添加Fe3O4粉末,如图是氧化沉淀法生产复印用Fe304粉末的流程简图。(资料:+2价的铁元素容易被空气中的氧气氧化)
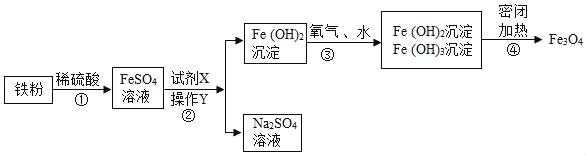
(1)判断铁粉己完全反应的现象是_____;
(2)操作Y的名称为_____,完成该操作所需的玻璃仪器有玻璃棒、烧杯、_____(填名称)。
(3)实验室在制备纯净的Fe(OH)2沉淀时,需要将吸有X试剂的胶头滴管伸到FeSO4溶液液面以下再滴,此操作的目的是_____。
(4)步骤②中涉及的反应方程式为_____,此反应的基本类型为_____。
【答案】气泡不再出现 过滤 漏斗 防止生成的沉淀被氧气氧化 FeSO4+2NaOH![]() Fe(OH)2↓+Na2SO4 复分解反应
Fe(OH)2↓+Na2SO4 复分解反应
【解析】
本题主要考查物质的相互转化和制备;过滤的原理、方法及其应用;金属的化学性质,根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式。
(1)铁粉与硫酸反应生成硫酸亚铁和氢气,当不再有气体出现时说明铁粉用完了。故填:气泡不再出现
(2)操作Y是将固体与液体分开,所以是过滤,过滤用的玻璃仪器有玻璃棒、漏斗、烧杯。故填:过滤 漏斗
(3)由题中资料可知+2价的铁元素容易被空气中的氧气氧化,故填:防止生成的沉淀被氧气氧化。
(4)通过题中的反应原理可以看出,硫酸亚铁和试剂X反应生成了氢氧化亚铁和硫酸钠溶液,结合复分解反应的原理可知,X是氢氧化钠溶液,氢氧化钠溶液和硫酸亚铁反应生成了硫酸钠和氢氧化亚铁沉淀,化学方程式为:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;

练习册系列答案
相关题目