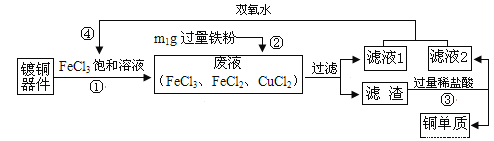
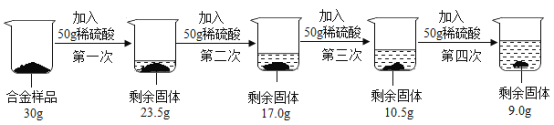
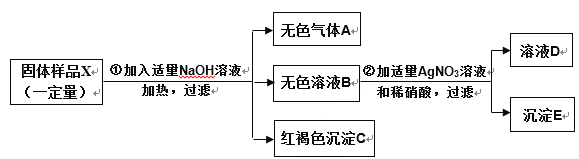
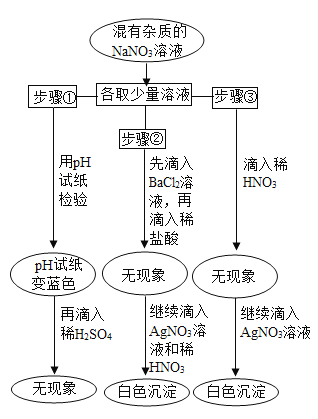
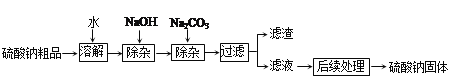
题目内容
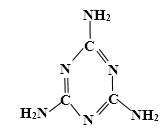
【题目】牛奶中蛋白质含量的测定是通过测定“氮”的含量实现的。三聚氰胺是一种低毒性化工产品,婴幼儿大量摄入会引起泌尿系统疾病,严重危害人体健康。不法奶商在牛奶中添加化工原料三聚氰胺(分子结构如图所示),以提升食品检测中的蛋白质含量指标,因此三聚氰胺也被人称为“蛋白精”。
(1)下列对三聚氰胺描述中,属于的化学性质的是_____。
A 快速加热升华,升华温度300 ℃
B 三聚氰胺为纯白色单斜棱晶体,无味
C 溶于热水,微溶于冷水,极微溶于热酒精
D 在一般情况下较稳定,但在高温下可能会分解放出氰化物
(2)下列关于三聚氰胺的说法中,正确的是_____。
A 添三聚氰胺能提高牛奶中的含氮量,但危害人体健康
B 三聚氰胺属于有机化合物
C “蛋白精”不是蛋白质,添加三聚氰胺不能提高食物中蛋白质含量
(3)请根据三聚氰胺的分子结构式写出化学式_____,其化学式的含义为_____(只写一条含义)。
【答案】D ABC C3N6H6 三聚氰胺是由碳、氢、氮三种元素组成的;一个三聚氰胺分子中共有15个原子等
【解析】
解:(1)三聚氰胺在高温下可能会分解放出氰化物需要通过化学变化表现出来,属于三聚氰胺的化学性质;
(2)添三聚氰胺能提高牛奶中的含氮量,但危害人体健康;三聚氰胺是含有碳元素的化合物,属于有机化合物;“蛋白精”不是蛋白质,添加三聚氰胺不能提高食物中蛋白质含量;
(3)由三聚氰胺的分子结构式可知,每个三聚氰胺分子中含有3个碳原子、6个氮原子、6个氢原子,化学式为:C3N6H6;三聚氰胺的化学式表示的含义有:三聚氰胺是由碳、氢、氮三种元素组成的;一个三聚氰胺分子中共有15个原子。

【题目】(1)在室温条件下,对100mL氯化钠饱和溶液进行如图所示操作:
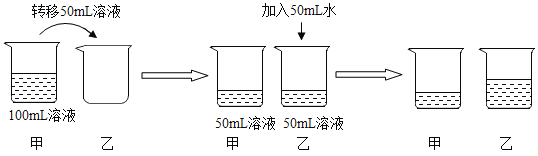
a.最终甲、乙两烧杯中溶液一定是饱和溶液的是_____。
b.乙溶液在加50mL水的过程中,下列这些量逐渐减小的是_____。
①溶解度 ②溶质质量分数 ③溶剂的质量 ④溶液的密度
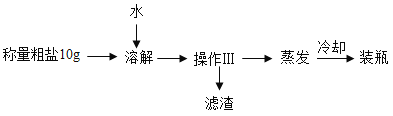
(2)提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
温度(℃) | 溶解度(g) |
20 | 36.0 |
40 | 36.6 |
60 | 37.3 |
①20℃时氯化钠的溶解度是_____
②该实验是利用泥沙难溶于水而氯化钠_____的性质进行提纯,操作Ⅲ的名称是_____。
③关于蒸发叙述正确的是_____(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中液滴飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
④溶解时,加入水的合适的量约为_____(选填“15”、“30” 或“60”)mL。