题目内容
【题目】学习小组利用黄铜(铜锌合金)完成以下性质实验。(装置气密性良好夹持装置省略)
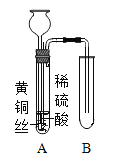
Ⅰ如图所示,将黄铜丝插入稀硫酸,观察到黄铜丝表面有气泡生成并开始溶解,A中导管里液面缓慢上升;
Ⅱ立即向长颈漏斗中加入过量的过氧化氢溶液,又观察到黄铜丝溶解加快,溶液变为蓝色,试管A管壁发热,A中部分溶液进入B中。
(1)I中发生反应的化学方程式为_____,能证明锌的金属活动性比铜强的现象是_____。
(2)写出A中溶液进入B中的原因。_____。
(3)反应结束后,将A、B中溶液倒入一个烧杯所得溶液中没有过氧化氢的理由是_____。根据该溶液中溶质的组成,自选一种试剂,对其进行无害化处理,写出实验操作和现象。_____。
【答案】![]() 有气泡产生 溶液颜色不变蓝 A中不断有气体生成且反应过程放热,气体体积膨胀,A中溶液被压入B中 过氧化氢在硫酸铜溶液的催化下完全分解,向烧杯中加入过量的铁粉,充分反应至不再有气泡产生,过滤,反应过程中有红色固体析出,有气泡产生
有气泡产生 溶液颜色不变蓝 A中不断有气体生成且反应过程放热,气体体积膨胀,A中溶液被压入B中 过氧化氢在硫酸铜溶液的催化下完全分解,向烧杯中加入过量的铁粉,充分反应至不再有气泡产生,过滤,反应过程中有红色固体析出,有气泡产生
【解析】
(1)根据黄铜中含有锌,锌和稀硫酸反应生成硫酸锌和氢气,锌会与稀硫酸反应,铜不会与稀硫酸反应进行分析;
(2)根据试管A管壁发热,锌和稀硫酸反应会生成氢气进行分析;
(3)根据硫酸铜可以催化过氧化氢分解生成水和氧气,黄铜丝溶解加快,溶液变为蓝色,说明溶液中含有硫酸铜,以及稀硫酸是过量的进行分析。
解:(1)黄铜中含有锌,锌和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑,锌会与稀硫酸反应,铜不会与稀硫酸反应,所以能证明锌的金属活动性比铜强的现象是:有气泡产生,溶液颜色不变蓝;
(2)试管A管壁发热,锌和稀硫酸反应会生成氢气,所以A中溶液进入B中的原因是:A中不断有气体生成且反应过程放热,气体体积膨胀,A中溶液被压入B中;
(3)硫酸铜可以催化过氧化氢分解生成水和氧气,所以将A、B中溶液倒入一个烧杯所得溶液中没有过氧化氢的理由是:过氧化氢在硫酸铜溶液的催化下完全分解,黄铜丝溶解加快,溶液变为蓝色,说明溶液中含有硫酸铜,以及稀硫酸是过量的,所以实验操作和现象是:向烧杯中加入过量的铁粉,充分反应至不再有气泡产生,过滤,反应过程中有红色固体析出,有气泡产生。
故答案为:(1)Zn+H2SO4═ZnSO4+H2↑,有气泡产生,溶液颜色不变蓝;(2)A中不断有气体生成且反应过程放热,气体体积膨胀,A中溶液被压入B中;(3)过氧化氢在硫酸铜溶液的催化下完全分解,向烧杯中加入过量的铁粉,充分反应至不再有气泡产生,过滤,反应过程中有红色固体析出,有气泡产生。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H 2O)和副产物石膏(CaSO4·2H 2O)的生产流程示意图:
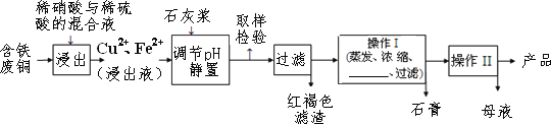
胆矾和石膏在不同温度下的溶解度(g/100g 水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是_________;
(2)含铁的废铜和稀硫酸反应的化学方程式_____
(3)操作 I 最后温度应该控制在_____℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_____、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_____。
【题目】实验室有一瓶保存不当的试剂(如图所示),其残缺的标签中只剩下“Na”和“10%”字样。已知它是无色液体,是初中化学常用的试剂,小华等几位同学对此很感兴趣,决定对其成分进行探究。
![]()
(提出问题)这瓶试剂溶质是什么?
(交流研讨)根据受损标签的情况判断,这瓶试剂不可能是_____(填酸、碱或盐)。
(查阅资料)
①初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
②Na2CO3、NaHCO3溶液都呈碱性。NaCl溶液呈中性。
③室温下(20℃)时,4种物质的溶解度的数据如下。
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶上标注和上表溶解度数据判断,这瓶试剂不可能是_____。
(猜想与实验)
这瓶试剂①可能是_____溶液;②可能是NaOH溶液;③可能是NaCl溶液。
(1)小亮用洁净的玻璃棒蘸取该溶液,滴到湿润的pH试纸上,测得pH=11,他判断该溶液不可能是氯化钠。对小亮的操作方法、测量结果及所得结论,你的评价是_____。
A 方法正确,pH正确,结论正确 B 方法不正确,pH偏小,但结论正确
C 方法不正确,pH偏大,结论不正确 D 方法正确,pH正确,但结论不正确
(2)小强为了确定该溶液的成分,进行了如下实验。
操作步骤 | 实验现象 | 结论及化学方程式 |
步骤一:取样品于试管中,滴加足量_____ | 产生大量的气泡 | 猜想①正确。步骤二发生反应的化学方程式是_____ |
步骤二:把产生的气体,通入_____ | _____ |
(质疑)小华则不同意小强的观点,认为溶液中有Na2CO3还可能有NaOH.请你帮助他完成以下探究方案:
探究步骤 | 预计现象 | 结论 |
步骤一:取样品于试管中,向其中滴加足量的_____溶液并过滤 | 产生白色沉淀 | 溶液中:既含Na2CO3,又含有NaOH |
步骤二:向上述滤液中滴加酚酞试液 | 酚酞试液呈_____色 |