题目内容
【题目】根据图示实验,回答下列问题。
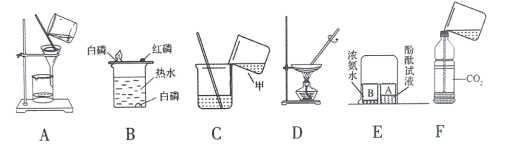
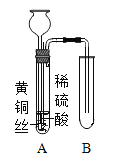
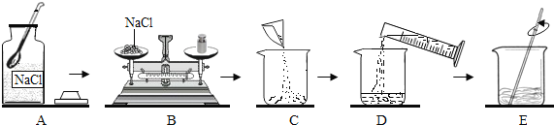
(1)图A实验中玻璃棒的作用是__________________;
(2)图B实验中,薄铜片上的白磷燃烧而红磷不燃烧的事实,说明物质燃烧的条件之一是________;
(3)图C是浓硫酸的稀释操作,甲中的液体是____________;
(4)图B实验中,热水作用是隔绝空气和______________________;
(5)图E实验,A中液体变红,说明分子的性质是__________________;
(6)图F实验,向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约三分之一体积的水,立即旋紧瓶盖并振荡,塑料瓶变瘪,由此说明二氧化碳的物理性质是_________________ 。
【答案】引流 温度达到着火点 提供热量,使可燃物温度达到着火点 浓硫酸 分子是不断运动的 能溶于水
【解析】
(1)在过滤操作中,玻璃棒的作用是引流;
(2)白磷的着火点是40℃,红磷的着火点是240℃,薄铜片上的白磷燃烧而红磷不燃烧,说明物质燃烧,温度需要达到着火点;
(3)稀释浓硫酸时,要将浓硫酸沿着烧杯壁慢慢注入水中,并不断的用玻璃棒进行搅拌;
(4)图B实验是探究燃烧条件的实验,热水的作用是隔绝空气和提供热量;
(5)浓氨水具有挥发性,挥发出来的氨气分子在不断的运动,与酚酞试液中的水结合成氨水,氨水显碱性能使无色的酚酞试液变红色;
(6)观察到软塑料瓶变瘪,这是因为二氧化碳溶于水,使瓶内气体压强减小,小于外界大气压的缘故。

【题目】用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色.实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究.
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁.
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质.
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁.
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是 .
【查阅资料】
①碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应.
②白色的硫酸铜粉末遇水能变为蓝色.
③碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O.
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可).
【进行实验】
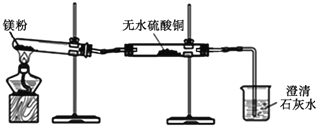
(1)同学们用久置的镁粉进行了如下实验.
实 验 装 置 |
|
实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
结 论 | 久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上.
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失.请写出有气体生成的一个反应化学方程式 .
②将实验①试管中的混合物进行 (填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热.黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生.
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质.
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁.
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是 .