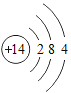题目内容
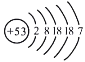
【题目】为了探究影响化学反应速率的因素,某化学兴趣小组的同学设计了如图所示的装置进行实验,收集的相关数据如下表:
实验序号 | H2O2溶液的浓度% | H2O2溶液的体积/mL | 催化剂/g | 温度/ | 收集相同体积的O2所需的时间/s |
① | 5 | 2 | 0.1gMnO2 | 20 | 18 |
② | 10 | 2 | 0.1gMnO2 | 20 | 6 |
③ | 30 | 8 | 未加 | 40 | 64 |
④ | 30 | 8 | 未加 | 60 | 25 |
⑤ | 10 | a | 0.1gCuO | b | 16 |
(1)过氧化氢溶液与二氧化锰反应的化学方程式____。
(2)由实验_____(填实验序号)知,化学反应速率与H2O2溶液的浓度有关;由实验③和④知,化学反应速率与温度的关系是_____。
(3)表中的数据还反映出不同的催化剂对双氧水溶液分解的催化效果不同,则表中的a=___,b=____
【答案】2H2O2![]() 2H2O+ O2↑ ①② 温度越高化学反应速率越快 2 20
2H2O+ O2↑ ①② 温度越高化学反应速率越快 2 20
【解析】
(1)过氧化氢和二氧化锰混合生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+ O2↑;故填:2H2O2
2H2O+ O2↑;故填:2H2O2![]() 2H2O+ O2↑;
2H2O+ O2↑;
(2)从表中分析可知:①②是过氧化氢浓度不同而其他的反应时各种量均相同,可知这一过程是考查反应物的浓度与反应速度的关系:③④则是温度不同其他条件相同,明显是对温度影响化学反应速度的探究,且温度越高化学反应速率越快;故填:①②;温度越高化学反应速率越快;
(3)探究不同的催化剂对双氧水溶液分解的催化效果不同应该是催化剂的种类不同外其他条件相同,所以表中的a=2,b= 20。故填:2;20。

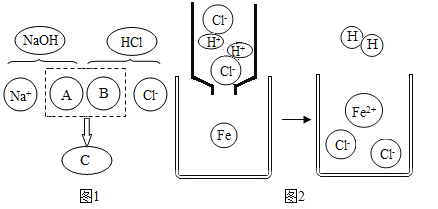
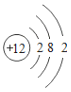
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
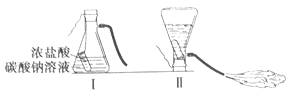
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。
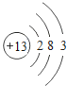
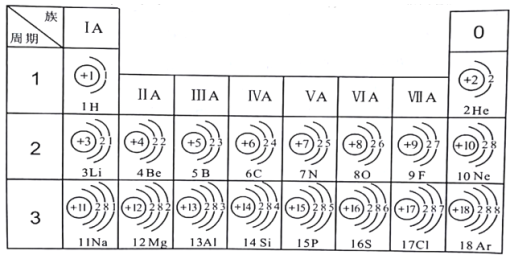
【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
请回答下列问题:
(1)表中硫原子的核电荷数x=_____,在化学反应中容易_____电子。
(2)表中具有相对稳定结构的元素是_____。
(3)写出铝离子的结构示意图_____。
(4)镁元素与氯元素形成的化合物化学式为_____。
(5)上述元素在周期表中处于同一周期的原因是_____。
【题目】某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)
猜想1:可能含有Na2CO3;
猜想2:可能含有NaCl;
猜想3:可能含有_____。
作出猜想1的依据是_____ (用化学方程式表示)。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
I、取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁。 | 试管外壁发热 | 原因是_____。 |
II、向I所得的溶液中逐滴加入 稀硝酸至过量 | 刚开始_____,一段时间后产生能使澄清石灰水变浑浊的气体。 | 猜想1可能成立。 |
III、向II所得的溶液中_____。 | 产生白色沉淀 | 结合实验II,猜想3成立。 |
(交流与讨论)
小坚同学提出:“上述实验II中稀硝酸也可以用稀盐酸代替”。你认为他的观点_____(填“正确”或“不正确”),理由是_____。