题目内容
【题目】某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”。某研究性学习小组对该厂生产的烧碱样品进行如下探究。
(提出问题)烧碱样品中可能含有哪些杂质?
(猜想)
猜想1:可能含有Na2CO3;
猜想2:可能含有NaCl;
猜想3:可能含有_____。
作出猜想1的依据是_____ (用化学方程式表示)。
(设计实验)
实验步骤 | 实验现象 | 解释或结论 |
I、取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁。 | 试管外壁发热 | 原因是_____。 |
II、向I所得的溶液中逐滴加入 稀硝酸至过量 | 刚开始_____,一段时间后产生能使澄清石灰水变浑浊的气体。 | 猜想1可能成立。 |
III、向II所得的溶液中_____。 | 产生白色沉淀 | 结合实验II,猜想3成立。 |
(交流与讨论)
小坚同学提出:“上述实验II中稀硝酸也可以用稀盐酸代替”。你认为他的观点_____(填“正确”或“不正确”),理由是_____。
【答案】Na2CO3和NaCl 2NaOH+CO2═Na2CO3+H2O 氢氧化钠固体溶于水放热 无明显现象 滴加几滴硝酸银溶液 不正确 加盐酸会引入Cl-,干扰对NaCl的检验
【解析】
氢氧化钠和二氧化碳生成的碳酸钠和水,氢氧化钠固体溶于水放热,氢氧化钠和稀硝酸反应生成硝酸钠和水,碳酸钠和稀硝酸反应生成硝酸钠、水和二氧化碳。
[猜想]
烧碱样品中可能含有氢氧化钠和空气中二氧化碳生成的碳酸钠,可能含有氯化钠,可能碳酸钠和氯化钠都有,故猜想3:可能含有Na2CO3和NaCl。
作出猜想1的依据是二氧化碳和氢氧化钠生成碳酸钠和水,反应的化学方程式为2NaOH+CO2=Na2CO3+H2O。
[设计实验]
氢氧化钠固体溶于水放热,氢氧化钠和稀硝酸反应生成硝酸钠和水,碳酸钠和稀硝酸反应生成硝酸钠、水和二氧化碳,二氧化碳能使澄清石灰水变浑浊,氯化钠和硝酸银反应生成氯化银和硝酸钠。
实验步骤 | 实验现象 | 解释或结论 |
I、取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁。 | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热。 |
II、向I所得的溶液中逐滴加入 稀硝酸至过量 | 刚开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体。 | 猜想1可能成立。 |
III、向II所得的溶液中滴加几滴硝酸银溶液。 | 产生白色沉淀 | 结合实验II,猜想3成立。 |
[交流与讨论]
氯化钠和硝酸银反应生成氯化银沉淀,稀盐酸和硝酸银反应也会生成氯化银沉淀,实验II中稀硝酸不能用稀盐酸代替,故观点不正确,理由是加盐酸会引入Cl-,干扰对NaCl的检验。

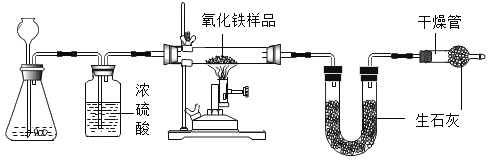
【题目】为了探究影响化学反应速率的因素,某化学兴趣小组的同学设计了如图所示的装置进行实验,收集的相关数据如下表:
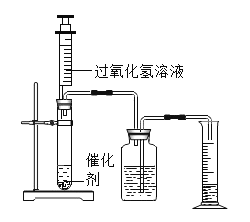
实验序号 | H2O2溶液的浓度% | H2O2溶液的体积/mL | 催化剂/g | 温度/ | 收集相同体积的O2所需的时间/s |
① | 5 | 2 | 0.1gMnO2 | 20 | 18 |
② | 10 | 2 | 0.1gMnO2 | 20 | 6 |
③ | 30 | 8 | 未加 | 40 | 64 |
④ | 30 | 8 | 未加 | 60 | 25 |
⑤ | 10 | a | 0.1gCuO | b | 16 |
(1)过氧化氢溶液与二氧化锰反应的化学方程式____。
(2)由实验_____(填实验序号)知,化学反应速率与H2O2溶液的浓度有关;由实验③和④知,化学反应速率与温度的关系是_____。
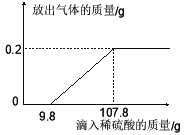
(3)表中的数据还反映出不同的催化剂对双氧水溶液分解的催化效果不同,则表中的a=___,b=____
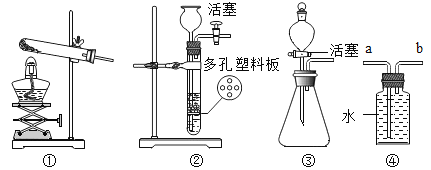
【题目】根据下列实验装置图,问答问题。
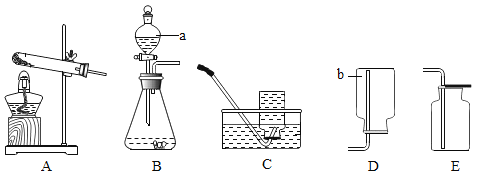
(1)写出标有序号的仪器名称:a__________,b_________。
(2)在实验室中用过氧化氢溶液和二氧化锰混合制取氧气时,发生反应的化学方程式为______,应选择的发生装置为_______。(填写装置的字母代号),若收集到的氧气不纯,可能的原因是______。(填序号)
①导管口一有气泡就马上收集
②装置漏气
③收集气体的集气瓶内未装满水
(3)若用 E 装置收集氧气,如何检验氧气已收集满? ______。
(4)小虎探究了影响双氧水分解速率的某种因素,实验数据记录如表:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生 O2的体积 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
小虎的实验结论是:________。
(5)实验室常用加热无水醋酸钠与碱石灰固体混合物来制取甲烷气体。要制取并收集甲烷(密度比空气小,难溶于水),可选用的发生、收集装置依次是____。