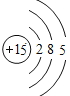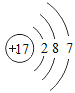题目内容
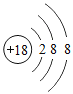
【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
请回答下列问题:
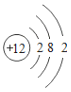
(1)表中硫原子的核电荷数x=_____,在化学反应中容易_____电子。
(2)表中具有相对稳定结构的元素是_____。
(3)写出铝离子的结构示意图_____。
(4)镁元素与氯元素形成的化合物化学式为_____。
(5)上述元素在周期表中处于同一周期的原因是_____。
【答案】16 得到 氩元素 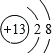 MgCl2 原子核外电子层数相同
MgCl2 原子核外电子层数相同
【解析】
在原子中,质子数=核外电子数,最外层电子数大于4,在反应中易得到电子,最外层具有8个电子(只有一层为2个电子)的原子具有相对稳定结构。
(1)在原子中,质子数=核外电子数,![]() ,其原子最外层有6个电子,在化学变化中易得到电子。
,其原子最外层有6个电子,在化学变化中易得到电子。
(2)最外层具有8个电子(只有一层为2个电子)的原子具有相对稳定结构,表中具有相对稳定结构的元素氩元素。
(3)铝离子是铝原子失去最外层3个电子形成的,故结构示意图为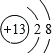 。
。
(4)镁元素与氯元素形成的化合物是氯化镁,镁元素显+2价,氯元素显1价,化学式为MgCl2。
(5)由元素周期表中某一周期元素的原子结构示意图可以看出,处于同一周期的原子,核外电子层数相同。

 名校课堂系列答案
名校课堂系列答案【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
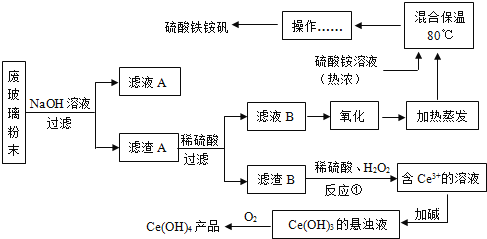
已知:1.SiO2+2NaOH=Na2SiO3+H2O
2.CeO2是一种金属氧化物,化学性质稳定,与稀硫酸不反应。在H2O2存在的条件下,两种物质能反应。
3.硫酸铁铵矾[Fe2(SO4)32(NH4)2SO43H2O]广泛用于水的净化处理.
(1)氧化铈(CeO2)中,铈的化合价为____________,检验硫酸铁铵溶液中含有NH4+的方法是:__________。
(2)为提高①中硫酸的反应效率,可采用的具体措施有_____________。(写一种即可)。
(3)操作应为_____________。
(4)反应①之前先要洗涤滤渣B,其目的是为了除去_____________(填离子符号)。
(5)请补充完整①反应的化学方程式:2CeO2+3H2SO4+H2O2=Ce2(SO4)3+_____+ ____↑。
(6)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。反应方程式为TeOSO4 +2SO2+3H2O![]() Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
实验 | 温度/℃ | 反应时间 | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
① a和b的结论是______________。
②为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗确沉淀率。若再设计对比实验,选择的反应条件还可以是_________。
A80℃,1.5h B80℃,2.5h C70℃,
【题目】为了探究影响化学反应速率的因素,某化学兴趣小组的同学设计了如图所示的装置进行实验,收集的相关数据如下表:
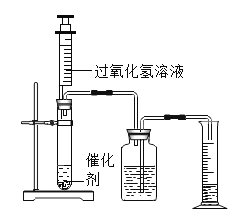
实验序号 | H2O2溶液的浓度% | H2O2溶液的体积/mL | 催化剂/g | 温度/ | 收集相同体积的O2所需的时间/s |
① | 5 | 2 | 0.1gMnO2 | 20 | 18 |
② | 10 | 2 | 0.1gMnO2 | 20 | 6 |
③ | 30 | 8 | 未加 | 40 | 64 |
④ | 30 | 8 | 未加 | 60 | 25 |
⑤ | 10 | a | 0.1gCuO | b | 16 |
(1)过氧化氢溶液与二氧化锰反应的化学方程式____。
(2)由实验_____(填实验序号)知,化学反应速率与H2O2溶液的浓度有关;由实验③和④知,化学反应速率与温度的关系是_____。
(3)表中的数据还反映出不同的催化剂对双氧水溶液分解的催化效果不同,则表中的a=___,b=____
【题目】除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是
选项 | 物质 | 选用的试剂 | 操作方法 |
A | NaOH溶液( | 氯化钙溶液 | 溶解、过滤、蒸发、结晶 |
B |
| 碳酸钙 | 加过量碳酸钙充分反应后过滤 |
C |
| 氢氧化钠溶液 | 过滤 |
D | CO( | 澄清石灰水 | 将混合气体通过澄清石灰水 |
A.AB.BC.CD.D