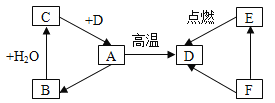
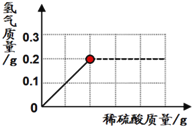
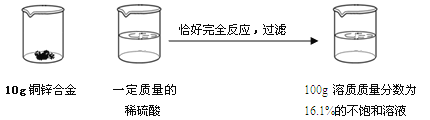
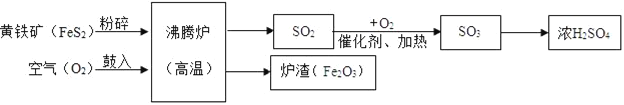
题目内容
【题目】石灰石不仅是重要的建筑材料,更是重要的工业原料。
(1)工业炼铁时常加入石灰石以除去铁矿石中的杂质![]() ,有关反应的化学方程式是
,有关反应的化学方程式是 ,其中X的化学式是__________。
,其中X的化学式是__________。
(2)石灰石可发生一系列转化:石灰石→生石灰→熟石灰,其中生石灰的化学式是________。用石灰石生产生石灰的反应,其基本反应类型是________。
【答案】CO2 CaO 分解反应
【解析】
(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式 ,反应前钙、碳、氧、硅原子个数分别为1、1、5、1,反应后的生成物中钙、碳、氧、硅原子个数分别为1、0、3、1,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和2个氧原子构成,物质X的化学式为CO2;
,反应前钙、碳、氧、硅原子个数分别为1、1、5、1,反应后的生成物中钙、碳、氧、硅原子个数分别为1、0、3、1,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和2个氧原子构成,物质X的化学式为CO2;
(2)生石灰的化学式是CaO;碳酸钙受热分解为氧化钙和二氧化碳,是由一种物质生成多种物质,属于分解反应。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】小丽在家帮妈妈清洗碗筷,因为家里洗洁精用完了,所以妈妈告诉小丽在水中加点食用碱(主要成分![]() )也可以洗掉碗筷上的油污,小丽按照妈妈的建议把碗筷洗得干干净净。第二天的化学实验课上,小丽和同组的小明、小亮一起探究“用碳酸钠溶液清洗油污时,究竟是哪种粒子起了作用?”
)也可以洗掉碗筷上的油污,小丽按照妈妈的建议把碗筷洗得干干净净。第二天的化学实验课上,小丽和同组的小明、小亮一起探究“用碳酸钠溶液清洗油污时,究竟是哪种粒子起了作用?”
(猜想与假设)
小明猜想:水分子起了作用。
小亮猜想:________起了作用。
小丽猜想:碳酸根离子起了作用。
(进行实验)
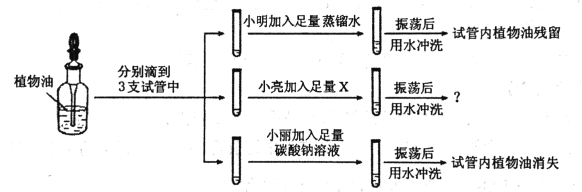
实验中小亮选用的X是________,振荡后用水冲洗,看到的现象是_________。由以上三个实验得出的结论是_________。
(反思与评价)
小明觉得上述实验的结论不准确,因为碳酸钠溶液呈碱性,溶液中一定存在________离子,很可能是这种离子起了清除油污的作用。同学们查阅资料发现:油污一般为酯类物质,在碱性条件下发生水解反应后生成可溶性的物质而使油污除去。于是他们补做了一个实验,证明小明的质疑是对的。
实验操作 | 实验现象 |
__________ | 试管内植物油消失 |
(表达与交流)
小丽告诉小组同学,食用碱在热水中溶解得快,其微观原因是_______。小亮则发现,用洗洁精与碱性溶液均可清洗油污,但二者清洗原理的不同点是______。