题目内容
【题目】请根据下图所示的实验过程和提供的数据计算
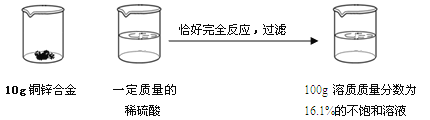
(1)生成氢气 g;
(2)合金中铜的质量分数是 ;
(3)所用稀硫酸的溶质质量分数是多少?(写出计算过程,计算结果保留到0.1%)
【答案】(1)0.2g (2)35% (3)10.5%
【解析】
试题分析:
设稀硫酸中硫酸的质量为x,生成氢气的质量为Y;需要金属锌的质量为Z
根据题意知生成ZnSO4的质量为100g×16.1%=16.1g
Zn+H2SO4=ZnSO4+H2↑
65 98 161 2
Z x 16.1g y
98:x=161:16.1g 161:16.1g=2:y 161:16.1g=65:z
x=9.8g y=0.2g z=6.5g
(1)生成氢气的质量为0.2g
(2)合金中铜的质量分数是;(10g-6.5g)/10g×100%=35%
(3)所用稀硫酸的溶质质量分数为 9.8g/(100g+0.2g-6.5g)×100% ≈10.5%
或9.8g/( 100g-16.1g)×100% ≈10.5%

练习册系列答案
相关题目