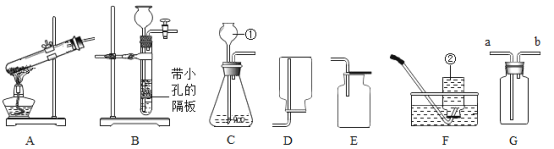
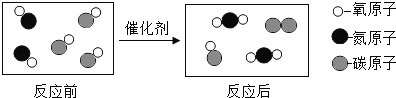
题目内容
【题目】当把燃着的小蜡烛放入一个集气瓶中并塞紧胶塞时,蜡烛一会儿就熄灭了。那么,蜡烛为什么会熄灭呢?某化学兴趣小组进行了如下探究,请你填答相关空格。
【提出猜想】猜想Ⅰ:蜡烛燃烧把集气瓶内的氧气耗尽,导致蜡烛熄灭。
猜想Ⅱ:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出的热量减少,使温度降至蜡烛的____________________以下,导致蜡烛熄灭。
猜想Ⅲ:蜡烛燃烧产生的二氧化碳能灭火,导致蜡烛熄灭。
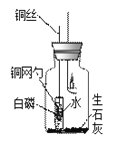
【进行实验】小组设计如下图所示的实验装置,并进行实验来验证猜想。
| 实验操作 | 实验现象 |
点燃蜡烛并连同胶塞上的其它仪器药品一起放入集气瓶中,塞紧胶塞 | 蜡烛火焰逐渐变微弱最终____ | |
蜡烛熄灭并静置冷却后,将铜丝上提,使盛白磷的铜网勺高于试管口,试管倒下,水流出。 | 一会儿后,白磷着火燃烧,有大量____产生 |
【分析及结论】
(1)蜡烛熄灭前,要让白磷浸没在小试管所盛的水中,目的是_________。
(2)集气瓶中装入一些生石灰的设计目的,是让它发生反应提高瓶内的_____,该反应的化学方程式为__________。
(3)瓶内的白磷能燃烧,证明猜想____和____不能成立。我们根据成立的猜想认为,应该把“燃烧需要氧气”这一燃烧发生的条件补充完善为“____________”。
【答案】 着火点 熄灭 白烟 防止白磷自燃 温度 CaO+H2O= Ca(OH)2 Ⅰ Ⅲ 燃烧需要氧气且要达到一定量
【解析】【提出猜想】猜想Ⅱ:根据灭火的原理解答;【进行实验】根据蜡烛燃烧消耗氧气及白磷燃烧产生大量白烟解答;【分析及结论】(1)根据白磷的着火点低解答;(2)根据生石灰与水反应,放出热量,使温度升高分析解答;(3)根据灭火的原理分析解答。【提出猜想】猜想Ⅱ:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出的热量减少,使温度降至蜡烛的着火点以下,导致蜡烛熄灭;【进行实验】实验现象:蜡烛燃烧,消耗氧气,使氧气含量减少,单质蜡烛火焰逐渐变微弱最终熄灭;白磷着火燃烧,有大量白烟产生;【分析及结论】(1)由于白磷的着火点较低,蜡烛熄灭前,要让白磷浸没在小试管所盛的水中,目的是防止白磷自燃;(2)集气瓶中装入一些生石灰的设计目的,是让它发生反应提高瓶内的温度,该反应的化学方程式为CaO+H2O= Ca(OH)2;(3)瓶内的白磷能燃烧,证明猜想Ⅰ和Ⅲ不能成立。我们根据成立的猜想认为,应该把“燃烧需要氧气”这一燃烧发生的条件补充完善为“燃烧需要氧气且要达到一定量”。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
(提出问题)过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
(查阅资料) ①人呼出的气体中主要成分是N2.O2.CO2和水蒸气等。
②CO2 + 2NaOH = Na2CO2 + H2O。
(提出猜想)过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
(进行实验)
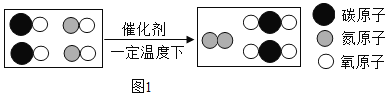
实验 Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如图1所示。
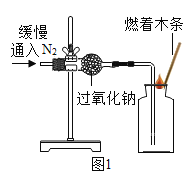
(2)实验现象及结论:观察到_________ 现象 ,判断过氧化钠与氮气没有发生反应。
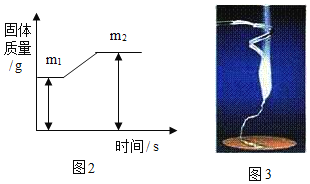
实验 Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
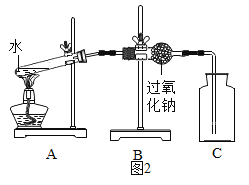
(1)同学们在老师的指导下设计了如图2所示装置。其中A装置的作用是________,发生的变化是______变化。
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验 Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如图3所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)
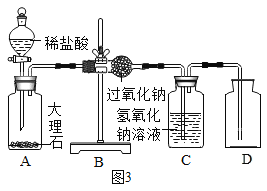
(2)实验记录
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性。向装置中加入药品 | 装置的气密性良好。 | |
② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸 | A装置中观察到的现象有_____,C装置中有气泡出现。 | A装置中发生反应的化学方程式为____; |
③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃 | 过氧化钠与二氧化碳反应并生成氧气 |
(实验反思)
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是________(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是____________________。
【题目】某实验小组利用废硫酸液制备K2SO4

(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
【题目】元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请回答下列问题:
1H | 2He | ||||||
3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |
(1)元素周期表中不同种元素最本质的区别是______(填字母)。
A.相对原子质量不同 B.质子数不同 C.中子数不同
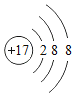
(2)镁元素的原子结构示意图为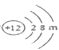 ,则m=______,该原子在化学反应中易______(填“得到”或“失去”)电子,说明元素的化学性质与原子的______关系密切。
,则m=______,该原子在化学反应中易______(填“得到”或“失去”)电子,说明元素的化学性质与原子的______关系密切。