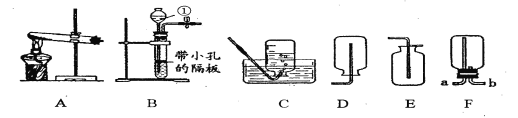
��Ŀ����
����Ŀ��ijʵ��С�����÷�����Һ�Ʊ�K2SO4

��1����CaCO3�гɷ�ĩ��Ŀ���� ��
��2�����������п�ѭ��ʹ�õ�������CO2�� ����д��ѧʽ����
��3����Ӧ����������ʵ��ܽ�����±�������Ϊ��Ӧ���ڳ�������ʵ�ֵ�ԭ����
���� | KCl | K2SO4 | NH4Cl | M |
�ܽ��/g��25���� | 34.0 | 11.1 | 37.2 | 19.5 |
��4������ˮ���ñ���K2SO4��Һϴ�ӷ�Ӧ�����þ����Ŀ���� ��Ϊ����˾����Ƿ�ϴ�Ӹɾ�����ȡ���һ��ϴ��Һ���ȼ��� ��ѡ����ţ���ͬ���������ã������ϲ���Һ�еμ� ���۲������жϣ�
a��AgNO3��Һ b��������BaCl2��Һ c��������Ba��NO3��2��Һ
���𰸡���1������Ӧ��֮��ĽӴ�������ӿ췴Ӧ���ʣ���2��CaCO3 ����3������������ص��ܽ��С����4����������ص���ģ�c ;a
��������
�����������1����CaCO3�гɷ�ĩ��Ŀ��������Ӧ��֮��ĽӴ�������ӿ췴Ӧ���ʣ���������ͼ��֪����2�� ��ѭ��ʹ�õ�������CO2��CaCO3 ����3����Ӧ���ڳ�������ʵ�ֵ�ԭ��������������ص��ܽ��С����4������ˮ���ñ���K2SO4��Һϴ�ӷ�Ӧ�����þ����Ŀ������������ص���ģ�Ϊ���������ؾ����Ƿ�ϴ�Ӹɾ�����ȡ���һ��ϴ��Һ���ȼ�����������ᱵ��Һ������������ӳ�ȥ����ֹ����������ʱ�ĸ��ţ��ڼ�����������Һ������������֤����ϴ�Ӹɾ���

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�