题目内容
【题目】日常生活与化学有着密切的联系。
(1)可燃冰主要成分是甲烷的水合物,可能成为未来新能源,写出甲烷燃烧的化学方程式_______。
(2)生活中利用洗涤剂的__________作用清洗衣服、餐具上的油污。
(3)室外野炊后,采用浇水的方式灭火,其灭火的原理是_____。
(4)漂白粉的制取原理为:2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2X,试推断方程式中X的化学式为___________。
【答案】CH4+2O2![]() CO2+2H2O 乳化 浇水后降低木材的温度到着火点以下,使火熄灭 H2O
CO2+2H2O 乳化 浇水后降低木材的温度到着火点以下,使火熄灭 H2O
【解析】
(1)甲烷和氧气在点燃的条件下生成水和二氧化碳,反应的化学方程式为CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)用洗涤剂清洗洗衣服、餐具上的油污,是利用了洗涤剂的乳化作用;
(3)室外野炊后,采用浇水的方式灭火,其灭火的原理是浇水后降低木材的温度到着火点以下,使火熄灭;
(4)在化学方程式2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2X中,反应前Cl:4,Ca:2,O:4,H:4,反应后Cl:4,Ca:2,O:2,根据质量守恒定律,在化学反应中原子的种类和数目不变,在2X中有4个氢原子和2个氧原子,X中含有2个氢原子和1个氧原子,故X为H2O。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
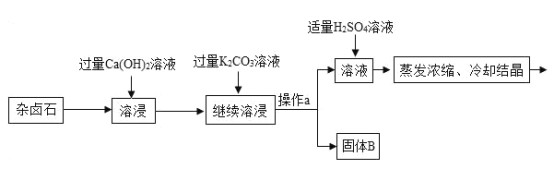
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是出去主要成分中的___;发生反应的化学方程式是___。
(2)操作a的名称是___。
(3)请写出固体B的两种主要成分___、___(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数乱来表示浸取率,在相同的时间里,进行了下述实验组:
实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
a | 25 | 2.5 | 72.4 |
b | 40 | 2.5 | 86.55 |
c | 40 | 3 | 90.02 |
d | 60 | 3 | 91.98 |
e | 60 | 4 | 91.45 |
①上述实验的数据中,温度与K+浸取率的关系是___。
②上述5组实验中,若要获得最佳的K+浸取率,选择的反应条件是___℃和Ca(OH)2___g。
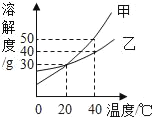
【题目】小金和小平两位同学进行“如图”两个实验。
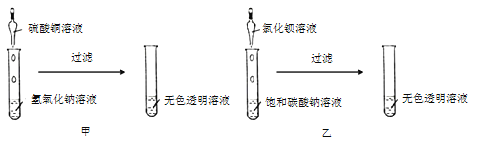
(l)甲实验中反应的化学方程式为_________;
(2)乙实验观察到的现象_____。
(3)实验结束后,两位同学把实验后的两支试管的溶液倒入同一个烧杯中,烧杯中没有明显现象,他们决定对溶液溶质成分进行探究。
(提出问题)烧杯中溶液的溶质成分是什么?
小金认为溶液的溶质一定有Na2SO4;小平认为溶液的溶质一定有____;溶质中还可能有什么?
(进行猜想)小金认为溶液的溶质可能有Na2CO3; 小平认为溶液的溶质可能有____;我认为溶液的溶质可能Na2CO3和NaOH都有。
(验证猜想)
实验操作 | 现象 | 结论 |
①取少量烧杯中的溶液于试管,测定pH。 | pH>7 | 溶液呈____性 |
②另取少量烧杯中的溶液于试管中,滴加足量BaCl2溶液,静置,再滴加无色酚酞。 | ____,溶液由无色变为红色。 | 我的猜想成立 |
(结论分析)小区认为实验操作②的结论不严谨,因为___;若要确定我的猜想是否成立,应另取少量烧杯中的溶液于试管中,滴加___,然后观察是否有___出现,反应的方程式为___。
(拓展与思考)如果实验操作①中测得的pH=7,烧杯中溶液的溶质成分是____;可见,探究反应后所得物质的成分时,既要考虑生成物,还要考虑反应物是否过量。