题目内容
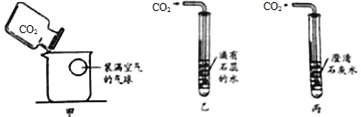
【题目】如图所示是某中学化学兴趣小组对二氧化碳与氢氧化钠溶液反应进行的创新实验。

已知:20℃时,氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解。
请回答下列问题:
(1)写出仪器a的名称 。
(2)按图组装好二氧化碳的发生装置,实验前要检查装置的 。
(3)反应装置中长颈漏斗的作用是 (填序号)。
A.添加稀盐酸 B.添加石灰水 C.添加稀盐酸和石灰石
(4)制取二氧化碳气体的化学反应方程式为 。
(5)将二氧化碳气体通入饱和氢氧化钠乙醇溶于中,马上又沉淀出现,出现这一现象的原因是 (请用文字表述)。
【答案】
(1)试管
(2)气密性
(3)A
(4)CaCO3+2HCl=CaCl2+H2O+CO2↑
(5)20℃时氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解
【解析】
试题分析:
(1)通过分析题中所指仪器的作用可知,a是试管;
(2)实验室制取气体时,在实验前要检查装置的气密性;
(3)实验室制取二氧化碳时,在锥形瓶中装石灰石,在长颈漏斗中添加稀盐酸,故选:A;
(4)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(5)20℃时氢氧化钠在乙醇中的溶解度为17.3g,而碳酸钠在乙醇中几乎不溶解,所以将二氧化碳气体通入饱和氢氧化钠乙醇溶于中,马上又沉淀出现。

【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100g,请计算该残余硫酸的溶质质量分数(写出详细的计算过程)。
【题目】下列相关说法用微观的知识解释正确的是
选项 | 相关说法 | 解释 |
A | 金刚石硬而石墨软 | 碳原子结构不同 |
B | 高架的电线夏天比冬天长 | 分子间隔随温度的升高而变大 |
C | 二氧化氮和氧气的颜色不同 | 分子的颜色不同 |
D | 一氧化碳和二氧化碳化学性质不同 | 分子结构不同 |