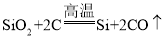题目内容
【题目】根据下图回答问题。
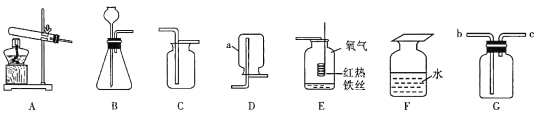
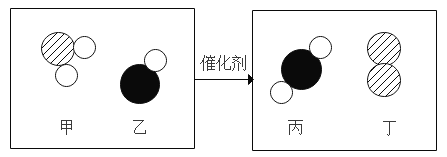
(1)仪器a的名称是_______。
(2)实验室用B装置制氧气的化学方程式为_______。装置E中发生反应的化学方程式为______
(3)实验室常使用仪器G来收集气体,若现在要收集氢气,则气体从__________(填“b”或“c”)端进入;有同学认为只要经过一定的改进措施,氧气也能从该端进入收集,则他的改进措施可能是________。
(4)探究带火星的木条在不同体积分数氧气中的复燃情况,部分实验数据记录如下表所示。已知空气中氧气的体积占1/5。
氧气体积分数/% | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
在集气瓶中注入占其容器50%的水(如图F所示),用排水法收集完氧气后,集气瓶内氧气的体积分数是__________,将带火星的木条伸入该集气瓶中,推测实验现象为______。
【答案】集气瓶 
 c 在集气瓶中装满水 60% 带火星的木条复燃
c 在集气瓶中装满水 60% 带火星的木条复燃
【解析】
(1)根据所学仪器的名称和用途,a的名称是集气瓶;
故填:集气瓶。
(2)B装置是固体与液体在常温下反应制取气体,用B装置制取氧气,所用的药品是过氧化氢溶液、二氧化锰,反应的化学方程式是: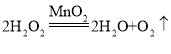 ,装置E中是铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式是
,装置E中是铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式是 ;
;
故填: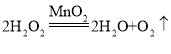

(3)实验室常使用仪器G来收集气体,要收集氢气,氢气的密度比空气的密度小,应从导管口在上的c端进入;氧气从c端进入收集,要采用排水法收集氧气,首先把集气瓶中装满水,氧气从c端进入,利用收集到的气体产生的压强将水排出;
故填:c 在集气瓶中装满水。
(4)设集气瓶的容积是100mL,装满50%的水,收集满氧气后,集气瓶中有50mL的氧气、50mL的空气;50mL的空气中氧气的体积是![]() ,氧气的总体积=50mL+10mL=60mL;则集气瓶中氧气的体积分数=
,氧气的总体积=50mL+10mL=60mL;则集气瓶中氧气的体积分数=![]() ,把带火星的木条伸入该集气瓶中,带火星的木条复燃;
,把带火星的木条伸入该集气瓶中,带火星的木条复燃;
故填:60% 带火星的木条复燃。

 愉快的寒假南京出版社系列答案
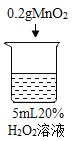
愉快的寒假南京出版社系列答案【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
初步探究:探究影响过氧化氢分解速率的因素
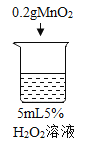
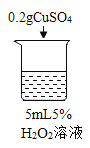
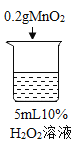
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
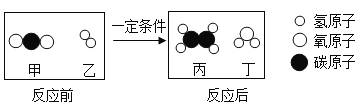
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰