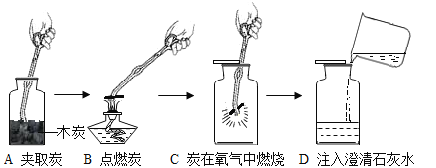
题目内容
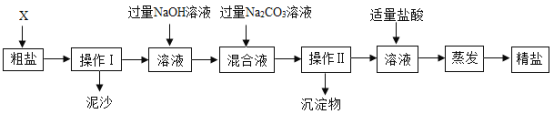
【题目】通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是_____。
(2)操作Ⅰ和操作Ⅱ的名称是______。
(3)在实验过程中加入过量的NaOH溶液,其实验目的是______,有关化学方程式是______。
(4)判断加入的盐酸“适量”的方法是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
【答案】水 过滤 将镁离子全部沉淀 MgCl2+2NaOH═Mg(OH)2↓+2NaCl 滴加盐酸无气泡放出为适宜 在粗盐提纯的过程中有氯化钠生成
【解析】
(1)海水晾晒得到的粗盐是固体,要进行提纯,需要先配成溶液,故答案为水.
(2)分离固体与溶液的方法是过滤,I、II都是分理处沉淀的过程.故答案为过滤.
(3)加入过量的氢氧化钠,氢氧根离子可以和镁离子转化为氢氧化镁沉淀而将镁离子除去.故答案为将镁离子全部沉淀;MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(4)此步是除掉多余的碳酸钠,而盐酸与碳酸钠反应是有气泡产生,从现象即可判断.故答案为滴加盐酸无气泡放出为适宜.
(5)在粗盐提纯的过程中,在提纯过程中生成了氯化钠.所以实验所得精盐的质量大于粗盐中NaCl的质量.故答案为在粗盐提纯的过程中有氯化钠生成.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。

(提出问题)久置固体的成分是什么?
(查阅资料)铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
(作出猜想)久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
(实验探究1)甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体于试管中,溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 | 固体中一定含_____和氢氧化钙 |
(2)另取少量固体于试管中,滴加足量的_____ | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 | 固体中一定含有______,一定不含Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | _______ | 固体中一定含有CaCO3 |
(实验质疑)
(1)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_________。
(2)丙同学认为甲同学的实验并不能得出一定不含FeO3的结论,理由是_________。
(实验探究2)乙、丙同学设计如下实验方案继续验证:
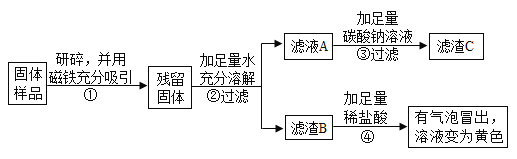
(1)乙、丙同学实验中又能得出固体样品中一定还含有_______,仍有一种物质不能确定,该物质是_______。
(2)乙、丙同学又经过实验测得上述3.9g残留固体中含钙物质的总质量为2.3g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为2.0g。
(实验结论)综合上述实验及所给数据:
(1)判断久置固体的成分是_______。
(2)计算上述残留固体中氧化钙的质量的质量为______克。
【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
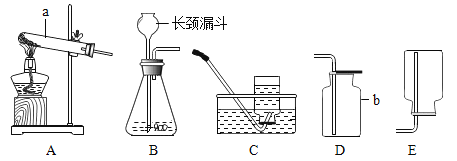
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
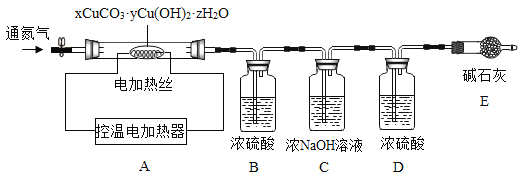
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
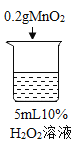
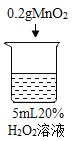
【题目】为探究过氧化氢的分解反应,同学们进行了以下实验。
(查阅资料)过氧化氢分解放热。当氧气低于一定浓度时,可燃物无法燃烧。
(进行实验)
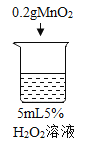
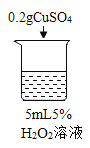
初步探究:探究影响过氧化氢分解速率的因素
序号 | 烧杯1 | 烧杯2 | 烧杯3 | 烧杯4 |
实验操作 |
|
|
|
|
实验现象 | 立即冒大量气泡,烧杯内有 少量白雾出现。 | 5分钟后,有比较大量的气泡冒出。 | 立即冒大量气泡,烧杯内有白雾。 | 立即冒大量气泡,烧杯内有大量白雾。 |
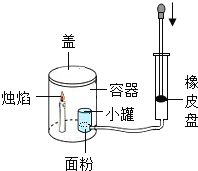
继续探究:重复烧杯1、3、4实验,并分别伸入带火星木条,如下图所示。
实验方案 | 序号 | 实验现象 |
| 烧杯1 | 木条复燃,燃烧很旺 |
烧杯3 | 木条复燃,之后火焰变微弱 | |
烧杯4 | 木条复燃,之后立即熄灭 |
span>
(结论与解释)
(1)写出烧杯1中反应的化学方程式_______。
(2)为证明MnO2和CuSO4能加快过氧化氢的分解速率,应增加的对比实验是_______(填具体操作)。
(3)能证明过氧化氢溶液浓度影响其分解速率的实验是_____(填烧杯的数字序号)。
(4)烧杯内出现大量白雾的原因是_______。
(反思与评价)
(5)烧杯4中木条熄灭的原因可能是_______。
(6)实验室若用双氧水制取氧气来完成木炭燃烧的实验,应选择的试剂是_______(填字母序号)。
A5%过氧化氢溶液 B10%过氧化氢溶液
C20%过氧化氢溶液 D二氧化锰