题目内容
【题目】空气是人类最宝贵的自然资源,空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程,请按要求回答下列问题:
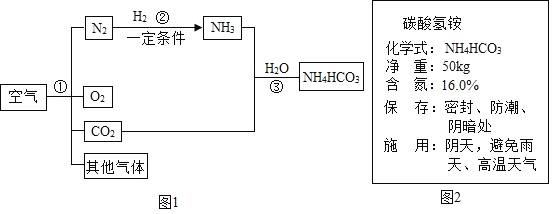
(1)步骤①中可利用氮气和氧气的_____不同分离出氮气和氧气。分离液态空气可得到合成氨所需要的氮气,是_____变化(填“物理”或者“化学”)。
(2)写出步骤②中发生反应的化学方程式_____。
(3)图2是化肥碳酸氢铵包装袋上的部分说明,这种化肥含氮量是否达到16%?带着问题,兴趣小组的同学取了一些化肥样品,进入实验室。
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3;
②浓硫酸能吸收NH3,但是不吸收CO2;
③氨气溶于水形成氨水。
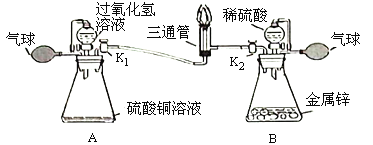
(性质探究)该同学设计了如下的实验装置:
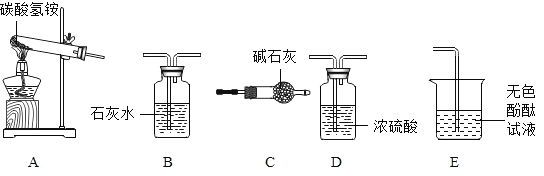
①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是_____。
②取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是_____。
③连接A、B装置,继续加热,观察到试管口的现象是_____,证明有水生成;B中的现象是_____,证明有二氧化碳生成。
④碳酸氢铵在受热时发生反应的化学方程式是_____。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失.
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
⑤由此分析得知:反应中产生氨气的质量为_____g。
⑥假设杂质中不含氮元素,请计算此化肥含氮元素的质量分数为_____。(写出计算过程)
【答案】沸点 物理 ![]() 检查装置的气密性 无色酚酞试液变红 水珠出现 澄清石灰水变浑浊
检查装置的气密性 无色酚酞试液变红 水珠出现 澄清石灰水变浑浊 ![]() 3.4g 14%
3.4g 14%
【解析】
(1)根据利用氮气和氧气的沸点不同可以分离出氮气和氧气进行分析;结合物理变化与化学变化的特点分析。
(2)根据氢气和氮气在一定条件下生成氨气进行分析;
(3)根据化肥碳酸氢铵包装袋上的部分说明进行分析并计算;①根据装药品前需要检查装置的气密性进行解答;②根据无色酚酞遇碱变红色进行分析;③根据碳酸氢铵受热分解生成氨气、二氧化碳和水进行解答;④根据碳酸氢铵受热分解生成氨气、二氧化碳和水进行解答;⑤根据质量守恒定律进行计算;
⑥根据氨气的质量求出此化肥中氮元素含量。
(1)利用氮气和氧气的沸点不同可以分离出氮气和氧气;由于变化中没有新物质生成,故其为物理变化。
(2)氢气和氮气在一定条件下生成氨气,反应的化学方程式为:![]() ;
;
(3)①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是:检查装置的气密性;②无色酚酞遇碱变红色,所以取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是无色酚酞试液变红;③碳酸氢铵受热分解生成氨气、二氧化碳和水,二氧化碳能使澄清石灰水变浑浊,所以观察到试管口的现象是有水珠出现,B中的现象是澄清石灰水变浑浊;④碳酸氢铵受热分解生成氨气、二氧化碳和水,反应的化学方程式是:![]() ; ⑤碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为152.4g-149g=3.4g;
; ⑤碱石灰能吸收水和二氧化碳,浓硫酸和氨气反应生成硫酸铵,所以实验后D装置增加的质量就是氨气的质量,所以氨气的质量为152.4g-149g=3.4g;
⑥化肥含氮元素质量分数为:
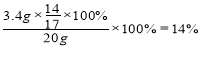

【题目】(一)小明在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据如图相关信息,回答下列问题:
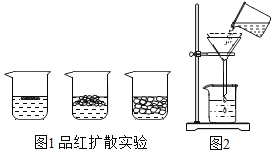
(1)图2过滤操作中必须用到的玻璃仪器分别是______、______、烧杯,请指出该操作过程中的其中两处错误______、______。
(2)小明同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是(填一种即可)______
(3)水是一种重要的资源,人类离不开水。在很长一段时期内,人类不了解水到底是由什么组成的。直到18世纪末,人类通过电解水实验才最终认识了水的组成。下列实验也能证明水是由氧元素和氢元素组成的是______(填序号)
A 氢气在氧气中燃烧 B 石蜡在空气中燃烧 C 水的蒸发 D 水的净化
(二)实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:______。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。
(完成实验)按下表进行试验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | KClO3 | 580 |
② | KClO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比l:1) | 370 |
④ | KClO3、Fe2O3(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验______形成对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是______。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和______;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证______。