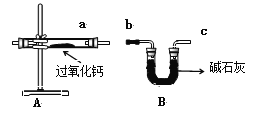
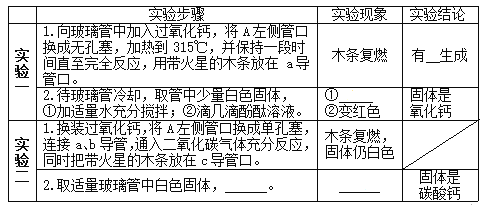
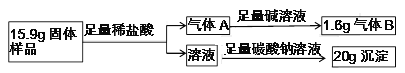
题目内容
【题目】CuCl2是一种广泛用于生产颜料、木材防腐剂等的化工产品。工业上以辉铜矿(主要含有Cu2S、Fe2O3及一些不溶性杂质)为原料制备CuCl22H2O晶体的工艺流程如下:

请回答下列问题:
(1)焙烧中生成黑色固体,反应的化学方程式为_______________________。
(2)酸浸时发生的化学方程式为___________________(写出一种),为加快反应速率,以下措施无法达到目的是_________________。
A.延长酸浸时间 B.将辉铜矿粉碎 C.适当增加盐酸浓度
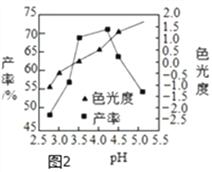
(3)色光度是产品质量指标之一,合格CuCl22H2O晶体的色光度范围为-0.5~0.5,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是____________。
(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是_________。
【答案】 Cu2S+O2![]() 2CuO+SO2 CuO + 2HCl ==CuCl2 + H2O(或Fe2O3 + 6HCl==2FeCl3 + 3H2O) A 3.5-4.0 防止氯化铜溶解,提高产率
2CuO+SO2 CuO + 2HCl ==CuCl2 + H2O(或Fe2O3 + 6HCl==2FeCl3 + 3H2O) A 3.5-4.0 防止氯化铜溶解,提高产率
【解析】(1)高温条件下,硫化亚铜和氧气反应生成氧化铜和二氧化硫,反应的化学方程式为:Cu2S+O2![]() 2CuO+SO2 (2)酸浸时,氧化铜和稀盐酸反应生成氯化铜和水,氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:CuO + 2HCl ==CuCl2 + H2O,Fe2O3 + 6HCl==2FeCl3 + 3H2O。A.延长酸浸时间不能加快反应速率;B.将辉铜矿粉碎,增大了反应物接触面积,能够加快反应速率;C.适当增加盐酸浓度,可用加快反应速率。故填A。(3)由图可知,pH为3.5---4.0时,产率较高,并且CuCl22H2O晶体的色光度范围在-0.5---0.5之间,属于合格产品,因此综合考虑,制备时应控制pH的较合理范围是3.5---4.0;(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是防止氯化铜溶解,提高产率。
2CuO+SO2 (2)酸浸时,氧化铜和稀盐酸反应生成氯化铜和水,氧化铁与稀盐酸反应生成氯化铁和水,反应的化学方程式为:CuO + 2HCl ==CuCl2 + H2O,Fe2O3 + 6HCl==2FeCl3 + 3H2O。A.延长酸浸时间不能加快反应速率;B.将辉铜矿粉碎,增大了反应物接触面积,能够加快反应速率;C.适当增加盐酸浓度,可用加快反应速率。故填A。(3)由图可知,pH为3.5---4.0时,产率较高,并且CuCl22H2O晶体的色光度范围在-0.5---0.5之间,属于合格产品,因此综合考虑,制备时应控制pH的较合理范围是3.5---4.0;(4)CuCl22H2O晶体可用氯化铜饱和溶液洗涤而不用蒸馏水的原因是防止氯化铜溶解,提高产率。

 初中学业考试导与练系列答案
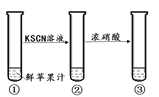
初中学业考试导与练系列答案【题目】同学们发现新鲜的苹果汁在空气中放置一段时间后会变色,仿佛铁生锈一样。于是,研究性小组同学设计并进行实验,探究苹果汁变色的原因。
(查阅资料)a.苹果汁中含有0.001%的二价铁物质,同时也含有多酚类物质,多酚可与空气中的氧气反应变为褐色。
b.二价铁在空气中或与浓硝酸反应都能变为三价铁,且三价铁的溶液为黄色。
c.硫氰化钾(KSCN)溶液遇二价铁溶液不变色,遇三价铁溶液变红色。
(猜想与假设)猜想Ⅰ.苹果汁变色与苹果中的铁元素有关;
猜想Ⅱ.苹果汁变色是苹果汁中的多酚物质与空气中的氧气反应的结果。
(进行实验)
编号 | 实验操作 | 实验现象 | |||
实验1 |
| ②中未出现明显变化 ③_________ | |||
实验2 | 分别放置于空气中一段时间 (如下图所示)
| 试管编号 | 1min | 10min | 24小时 |
① | 黄褐色 | 褐色 | 深褐色 | ||
② | 无明显变化 | 无明显变化 | 无明显 变化 | ||
③ | 略有些黄色 | 浅黄 | 黄色 | ||
(解释与结论)(1)实验1验证了苹果汁中含有二价铁物质。在该实验试管③中的现象是______________;
(2)实验2的试管②中,FeSO4溶液中溶质的质量分数x的数值为__________,该实验得出的结论是猜想Ⅰ不成立;
(进一步探究)验证猜想Ⅱ成立的操作:将除去________的空气通入鲜苹果汁中;观察到实验现象是__________________________;
(反思与应用)生活中为了防止苹果汁变色,可以采用的一种方法是:________。