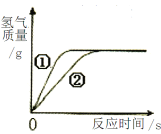
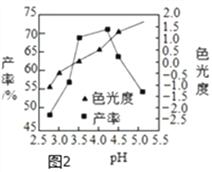
题目内容
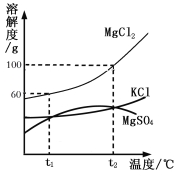
【题目】如图为甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
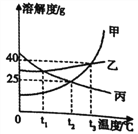
A. 若乙中含有少量甲,可采用冷却热饱和溶液的方法提纯乙
B. 当t1℃< t<t2℃时,丙溶液的质量分数大于甲溶液
C. 甲、乙、丙三种物质的饱和溶液从t1℃升温至t3℃,所得溶液的质量分数关系是甲=乙>丙
D. 将t3℃时甲、乙、丙三种物质的饱和溶液各恒温蒸发10g水,析出固体质量的关系是甲=乙>丙
【答案】D
【解析】A、乙的溶解度随温度的变化不大,乙中含有少量甲,可采用蒸发结晶的方法提纯乙,错误;B、不知溶液是否饱和,也不知溶质、溶剂的质量多少,无法判断溶质的质量分数大小,错误;C、将t3℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温到t1℃,丙的溶质质量分数不变,甲和乙的都有晶体析出,溶质质量分数会减小,根据图象可以看出,在t1℃时甲、乙、丙三种物质的溶解度是乙=丙>甲,甲、乙、丙三种物质的饱和溶液从t1℃升温至t3℃,丙的溶解度减小,丙溶解的质量仍大于甲,故从t1℃升温至t3℃时,所得溶液的质量分数关系是乙>丙>甲,错误;D、将t3℃时甲、乙、丙三种物质的饱和溶液各恒温蒸发10g水,甲和乙析出的晶体质量相等,故析出固体质量的关系是甲=乙>丙,正确。故选D。

【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
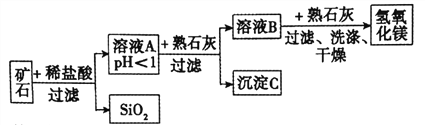
请回答下列问题。
(1)加稀盐酸之前要将矿石粉碎的目的是_____________。
(2)溶液A中除了Mg2+外,还含有的金属阳离子是______________;(写离子符号)
写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:______________(只写一个)。
(3)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为______________。(用不等式表示)
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出溶液B中加入熟石灰发生反应的化学方程式:___________________________。