题目内容
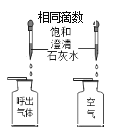
【题目】过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如下图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑
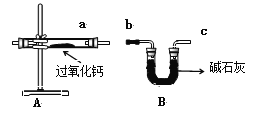
(实验探究)
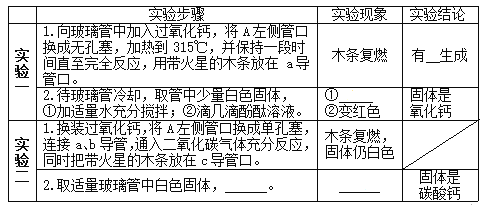
________________ ___________________ ________________ ____________
(解释与结论)
⑴由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
⑵由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:________。
⑶B装置中碱石灰的作用是:_________
(分析与计算)
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为 _______。
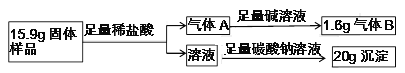
【答案】 氧气(或O2) 放热(或水温升高) 加入稀盐酸,把气体通入澄清的石灰水中 有气泡,石灰水变浑浊 CaO+H2O= Ca(OH)2 2CaO2+2CO2=2CaCO3+O2 吸收未反应的二氧化碳气体(或除二氧化碳气体或除去氧气中的二氧化碳) CaO2 :Ca(OH)2 :CaCO3=72:37:50
【解析】【实验探究】氧气有助燃性,能使带火星的木条复燃,所以木条复燃,证明过氧化钙受热后生成氧气;氧化钙和水反应生成氢氧化钙,放出大量热,溶液呈碱性,使无色酚酞试液变红;向样品中加入足量盐酸,有气体生产,把气体通入澄清的石灰水中 ,石灰水变浑浊,证明生成二氧化碳,进而证明样品中的物质有碳酸盐,据质量守恒定律,反应前后元素的种类不变,所以为碳酸钙;【解释与结论】⑴氧化钙和水反应方程式为:CaO+H2O= Ca(OH)2;⑵过氧化钙能与二氧化碳发生反应,生成碳酸钙和氧气,化学方程式:2CaO2+2CO2=2CaCO3+O2;⑶B装置中碱石灰的作用是:吸收未反应的二氧化碳气体(或除二氧化碳气体或除去氧气中的二氧化碳),使得到的氧气更纯;【分析与计算】二氧化碳能与碱的溶液反应生成盐和水,所以被碱溶液吸收后所得气体为氧气,设过氧化钙的质量为x,生成氯化钙的质量为y
2CaO2+4HCl=2CaCl2+2H2O+O2↑
144 222 32
X y 1.6g
144/x=32/1.6g x=7.2g
222/y=32/1.6g y=11.1g
设与碳酸钠反应生成碳酸钙的氯化钙的总质量为m
Na2CO3 + CaCl2== CaCO3↓+ 2NaCl
111 100
m 20g
111/m=100/20g m=22.2g 样品共15.9g,所以氢氧化钙和碳酸钙共8.7g。
所以碳酸钙、氢氧化钙和盐酸反应生成氯化钙的质量为:22.2g- 11.1g=11.1g,
设样品中 氢氧化钙的质量为a,生成氯化钙的质量为n1,
碳酸钙的质量为8.7g-a,生成氯化钙的质量为11.1g -n1
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 111
8.7g-a 11.1g -n1
得 ①100/(8.7g-a)=111/(11.1g -n1)
Ca(OH)2+ 2HCl == CaCl2 + 2H2O
74 111
a n1
得 ②74/a=111/n1
由①②得a=3.7 8.7g-a=5g,
固体中各成分的质量比为:CaO2 :Ca(OH)2 :CaCO3=7.2g:3.7g:5g=72:37:50。